 |
Химическая природа и строение белков
|
|
|
|
Лекция 4. Процессы, формирующие качество продукции общественного питания – 2 часа
План:
1. Изменения белков.
2. Химическая природа и строение белков.
3. Технологические свойства белков.
Изменения белков
Белки относятся к основным химическим компонентам пищи. Они имеют и другое название — протеины, которое подчеркивает первостепенное биологическое значение этой группы веществ (от гр. protos — первый, важнейший).
Значение белков в кулинарных рецептурах.
! Белки являются структурными элементами клеток;
! служат материалом для образования ферментов, гормонов и др.;
! влияют на усвояемость жиров, углеводов, витаминов, минеральных веществ и т. д.
! Ежесекундно в нашем организме отмирают миллионы клеток и для восстановления их взрослому человеку требуется 80—100 г белка в сутки, причем заменить его другими веществами невозможно.
G Поэтому технологи, занятые организацией питания постоянного контингента потребителей по дневным рационам (интернаты, санатории, больницы и т. д.) или скомплектованному меню отдельных приемов пищи, должны обеспечивать содержание белка в блюдах, соответствующее физиологическим потребностям человека.
Пользуясь таблицами химического состава готовых блюд, можно разработать меню рациона так, чтобы удовлетворить потребность питающихся в белках, как по количеству, так и по качеству, т. е. обеспечить биологическую ценность.
Биологическая ценность белков определяется содержанием незаменимых аминокислот (НАК), их соотношением и перевариваемостью.
G Белки, содержащие все НАК (их восемь: триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин, фенилаланин) и в тех соотношениях, в каких они входят в белки нашего организма, называются полноценными.
|
|
|
К ним относятся белки мяса, рыбы, яиц, молока.
G В растительных белках, как правило, недостаточно лизина, метионина, триптофана и некоторых других НАК. Так, в гречневой крупе недостает лейцина, в рисе и пшене — лизина.
G Незаменимая аминокислота, которой меньше всего в данном белке, называется лимитирующей. Остальные аминокислоты усваиваются в адекватных с ней количествах. Один продукт может дополнять другой по содержанию аминокислот. Однако такое взаимное обогащение происходит только в том случае, если эти продукты поступают в организм с разрывом во времени не более чем 2—3 ч.
G Поэтому большое значение имеет сбалансированность по аминокислотному составу не только суточных рационов, но и отдельных приемов пищи и даже блюд. Это необходимо учитывать при создании рецептур блюд и кулинарных изделий, сбалансированных по содержанию НАК.
Наиболее удачными комбинациями белковых продуктов являются:
* мука + творог (ватрушки, вареники, пироги с творогом);
* картофель + мясо, рыба или яйцо (картофельная запеканка с мясом, мясное рагу, рыбные котлеты с картофелем и др.);
* гречневая, овсяная каша + молоко, творог (крупеники, каши с молоком и др.);
* бобовые с яйцом, рыбой или мясом.
Наиболее эффективное взаимное обогащение белков достигается при их определенном соотношении, например:
* 5 частей мяса + 10 частей картофеля;
* 5 частей молока + 10 частей овощей;
* 5 частей рыбы + 10 частей овощей;
* 2 части яиц + 10 частей овощей (картофеля) и т. д.
G Усвояемость белков зависит от их физико-химических свойств, способов и степени тепловой обработки продуктов. Например, белки многих растительных продуктов плохо перевариваются, так как заключены в оболочки из клетчатки и других веществ, препятствующих действию пищеварительных ферментов (бобовые, крупы из цельных зерен, орехи и др.). Кроме того, в ряде растительных продуктов содержатся вещества, тормозящие действие пищеварительных ферментов (фазиолин фасоли).
|
|
|
G По скорости переваривания
ü на первом месте находятся белки яиц, молочных продуктов и рыбы,
ü затем мяса (говядина, свинина, баранина) и, наконец,
ü хлеба и крупы.
G Из белков животных продуктов в кишечнике всасывается более 90% аминокислот, из растительных — 60—80%.
G Размягчение продуктов при тепловой обработке и протирание их улучшает усвояемость белков, особенно растительного происхождения. Однако при избыточном нагревании содержание НАК может уменьшиться.
! Так, при длительной тепловой обработке в ряде продуктов снижается количество доступного для усвоения лизина. Этим объясняется меньшая усвояемость белков каш, сваренных на молоке, по сравнению с белками каш, сваренных на воде, но подаваемых с молоком.
! Чтобы повысить усвояемость каш, рекомендуется крупу предварительно замачивать для сокращения времени варки и добавлять молоко перед окончанием тепловой обработки.
Качество белка оценивается рядом показателей
- КЭБ — коэффициент эффективности белка,
- ЧУБ — чистая утилизация белка и др.), которые рассматривает физиология питания.
Химическая природа и строение белков
Белки — это природные полимеры, состоящие из остатков сотен и тысяч аминокислот, соединенных пептидной связью. От набора аминокислот и их порядка в полипептидных цепях зависят индивидуальные свойства белков.
По форме молекулы все белки можно разделить на
! глобулярные (молекула глобулярных белков по форме близка к шару)
! фибриллярные (молекула имеет форму волокна).
По растворимости все белки делятся на следующие группы:
! растворимые в воде — альбумины;
! растворимые в солевых растворах — глобулины;
! растворимые в спирте — проламины;
! растворимые в щелочах — глютелины.
По степени сложности белки делятся на
! протеины (простые белки), состоящие только из остатков аминокислот, и
! протеиды (сложные белки), состоящие из белковой и небелковой частей.
Различают четыре структуры организации белка:
! первичная — последовательное соединение аминокислотных остатков в полипептидной цепи;
|
|
|
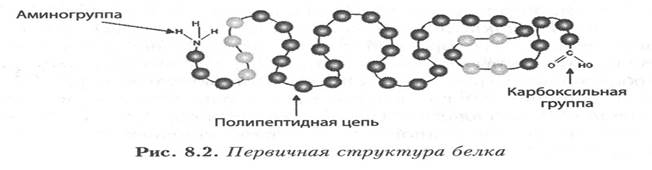
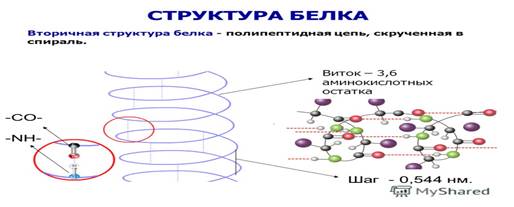
! вторичная — закручивание полипептидных цепей в спирали;
! третичная — свертывание полипептидной цепи в глобулу;

! четвертичная — объединение нескольких частиц с третичной структурой в одну более крупную частицу.

Белки обладают свободными карбоксильными или кислотными и аминогруппами, в результате чего они амфотерны, т. е. в зависимости от реакции среды проявляют себя как кислоты или как щелочи.
|
! В кислой среде белки проявляют щелочные свойства, и частицы их приобретают положительные заряды,
! в щелочной они ведут себя как кислоты, и частицы их становятся отрицательно заряженными.
При определенном рН среды (изоэлектрическая точка) число положительных и отрицательных зарядов в молекуле белка одинаково.
! Белки в этой точке электронейтральны, а их вязкость и растворимость наименьшие.
! Для большинства белков изоэлектрическая точка лежит в слабокислой среде.
Каждый белок характеризуется своей изоэлектрической точкой (pH):
ü пепсин — 1,0;
ü яичный альбумин — 4,7;
ü сывороточный альбумин — 4,59;
ü желатин — 5,05;
ü лактоглобулин — 5,1;
ü фосфо- рилаза — 5,8; гемоглобин — 6,87;
ü химотрипсин — 8,6;
ü рибонук- леаза — 9,4;
ü лизоцим — 10,5;
ü цитохром — 10,65.
|
|
|


