 |
Организация медицинской помощи новорожденным в перинатальном центре
|
|
|
|
Зарубежный опыт и логика развития событий подсказывают необходимость перехода к новой для нашей страны организационной форме охраны материнства и детства — перинатальным центрам.
Эта форма представляется наиболее прогрессивной и перспективной. Ведь интенсивная терапия в таких учреждениях, где концентрируются беременные высокого риска и, следовательно, транспортировка осуществляется in utero, начинается на уровне плода и продолжается непосредственно после рождения в отделении интенсивной терапии. Только одна эта организационная мера позволяет более чем в 2 раза снизить смертность среди новорожденных с очень низкой массой тела.
Известно также, что в нашей стране более половины пациентов, умерших в неонатальном периоде, погибают в 1-е сутки жизни.
Таким образом, организационная стратегия в обсуждаемой проблеме заключается в максимальном приближении высококвалифицированной реанимации и интенсивной терапии к первым минутам и часам жизни.
Хотя первичная помощь и реанимация новорожденным независимо от организационного уровня родовспомогательного учреждения оказывается по единой схеме, утвержденной приказом МЗ РФ № 372 от 28.12.95 г., тем не менее наибольшие возможности для ее эффективного осуществления имеются в перинатальном центре.
При оказании первичной и реанимационной помощи новорожденному необходимо строго соблюдать следующую последовательность действий:
1) прогнозирование необходимости реанимационных мероприятий и подготовка к их выполнению;
2) оценка состояния ребенка сразу после рождения;
3) восстановление свободной проходимости дыхательных путей;
4) восстановление адекватного дыхания;
|
|
|
5) восстановление адекватной сердечной деятельности;
6) введение медикаментов.
Процесс подготовки включает в себя:
1. Создание оптимальной температурной среды для новорожденного ребенка (поддержание температуры воздуха в родильном зале и в операционной не ниже 24 °С и установка источника лучистого тепла, заранее нагретого).
2. Подготовку реанимационного оборудования, размещенного в операционной и доступного для использования при первой необходимости.
Объем первичной помощи и реанимации зависит от состояния ребенка сразу после рождения.
При решении вопроса о начале лечебных мероприятий необходимо оценить выраженность признаков живорожденности, к каковым относятся самостоятельное дыхание, сердцебиение, пульсация пуповины и произвольные движения мышц. При отсутствии всех указанных четырех признаков ребенок считается мертворожденным и реанимации не подлежит.
Если у ребенка отмечается хотя бы один из признаков живорождения, ему необходимо оказать первичную и реанимационную помощь. Объем и последовательность реанимационных мероприятий зависят от выраженности трех основных признаков, характеризующих состояние жизненно важных функций новорожденного: самостоятельного дыхания, частоты сердечных сокращений и цвета кожных покровов.
Реанимационные мероприятия заключаются в следующем. После фиксации времени рождения ребенка, помещения его под источник лучистого тепла, обтирания теплой пеленкой новорожденному придают положение со слегка запрокинутой головой на спине с валиком под плечами или на правом боку и проводят отсасывание сначала содержимого ротовой полости, затем носовых ходов. При использовании электроотсоса разрежение не должно превышать 0,1 атм. (100 мм рт. ст.). Катетером нельзя касаться задней стенки глотки во избежание асфиксии. Если околоплодные воды окрашены меконием, то отсасывание содержимого ротовой полости и носовых ходов нужно произвести уже при рождении головки, а после рождения ребенка необходимо провести прямую ларингоскопию и санировать трахею через интубационную трубку. Через 5 мин после рождения с целью уменьшения вероятности апноэ и брадикардии следует провести отсасывание содержимого из желудка.
|
|
|
Далее производится оценка дыхания. В благоприятном варианте это будет регулярное спонтанное дыхание, что позволяет оценить частоту сердечных сокращений. Если она выше 100 уд/мин, оценивается окраска кожных покровов. В случае цианотичности кожи проводится ингаляция кислорода и продолжается наблюдение за новорожденным.
Если дыхание отсутствует или нерегулярно, то необходимо провести искусственную вентиляцию легких мешком «Амбу» 100% кислородом в течение 15—30 с. Такое же мероприятие проводится и при спонтанном дыхании, но выраженной брадикардии (число сердечных сокращений менее 100 уд/мин).
В большинстве случаев масочная вентиляция эффективна, но она противопоказана при подозрении на диафрагмальную грыжу.
Маску накладывают на лицо ребенка таким образом, чтобы верхняя часть обтуратора легла на переносицу, а нижняя — на подбородок. После проверки герметичности наложения маски необходимо сжать мешок 2—3 раза всей кистью, наблюдая при этом за экскурсией грудной клетки. Если экскурсия последней удовлетворительна, необходимо приступить к проведению начального этапа вентиляции при частоте дыхания 40 уд/мин (10 вдохов за 15 с).
В тех случаях, когда масочная искусственная вентиляция легких продолжается более 2 мин, следует ввести в желудок через рот стерильный желудочный зонд № 8 (зонд большего диаметра нарушит герметичность дыхательного контура). Глубина введения равна расстоянию от переносицы до мочки уха и далее — до мечевидного отростка.
С помощью шприца емкостью 20 мл через зонд необходимо плавно отсосать содержимое желудка, после чего зонд фиксируют лейкопластырем на щеке ребенка и оставляют открытым на весь период масочной вентиляции легких. При сохранении вздутия живота после завершения искусственной вентиляции целесообразно оставить зонд в желудке до ликвидации признаков метеоризма.
При двусторонней атрезии хоан, синдроме Пьера Робена, невозможности обеспечить свободную проходимость верхних дыхательных путей при правильной укладке ребенка в ходе масочной вентиляции следует использовать воздуховод, который должен свободно помещаться над языком и доставать до задней стенки глотки. Манжета при этом остается на губах ребенка.
|
|
|
Если после первичной масочной вентиляции число сердцебиений больше 100 уд/мин, то следует дождаться спонтанных дыхательных движений, после чего прекратить искусственную вентиляцию легких.
При брадикардии ниже 100, но выше 80 уд/мин масочная искусственная вентиляция легких должна проводиться в течение 30 с, после чего вновь оценивают число сердечных сокращений.
При брадикардии ниже 80 уд/мин наряду с масочной искусственной вентиляцией легких необходимо проводить непрямой массаж сердца в течение тех же 30 с.
Непрямой массаж сердца может быть проведен одним из двух способов:
1) с помощью двух пальцев (указательного и среднего или среднего и безымянного) одной кисти;
2) с помощью больших пальцев обеих кистей, охватывая ими грудную клетку пациента.
В обоих случаях ребенок должен находиться на твердой поверхности и надавливания на грудину следует осуществлять на границе средней и нижней трети с амплитудой 1,5—2,0 см и частотой 120 уд/мин (два сжатия в секунду).
Искусственная вентиляция легких во время массажа сердца проводится с частотой 40 циклов в 1 мин. При этом сжатия грудины необходимо осуществлять только в фазу выдоха при соотношении «вдох / нажатия грудины» — 1:3. При проведении непрямого массажа сердца на фоне масочной искусственной вентиляции легких обязательно введение желудочного зонда для декомпрессии.
Если после очередного контроля за частотой сердцебиений, сохраняется брадикардия менее 80 уд/мин, показаны интубация трахеи, продолжение искусственной вентиляции легких, непрямого массажа сердца и введение эндотрахеально 0,1—0,3 мл/кг адреналина в разведении 1:10 000.
Если при проведении искусственной вентиляции легких через интубационную трубку имеется возможность контролировать давление в дыхательных путях, то первые 2—3 вдоха следует выполнять с максимальным давлением на вдохе 30—40 см вод. ст. В дальнейшем давление на вдохе должно составлять 15—20 см вод. ст., а при мекониальной аспирации 20—40 см вод. ст., положительное давление в конце выдоха — 2 см вод. ст.
|
|
|
Через 30 с вновь проводится контроль за частотой сердечных сокращений. Если пульс чаще 100 уд/мин, непрямой массаж сердца прекращается, а ИВЛ продолжается до появления регулярного дыхания. В том случае, когда пульс остается менее 100 уд/мин, ИВЛ и непрямой массаж сердца продолжаются и катетеризируется пупочная вена, в которую вводится 0,1—0,3 мл/кг адреналина в разведении 1:10 000.
Если брадикардия сохраняется и имеются признаки гиповолемии при продолжающихся искусственной вентиляции легких и непрямом массаже сердца, необходимо начинать внутривенную инфузию изотонического раствора натрия хлорида или 5% альбумина в дозе 10 мл/кг, а также 4% раствора гидрокарбоната натрия из расчета 4 мл/кг в 1 мин. При этом скорость введения — 2 мл/кг в 1 мин (не быстрее чем за 2 мин).
Применение гидрокарбоната натрия целесообразно только на фоне адекватной ИВЛ при реанимации детей, пострадавших от длительной гипоксии. При острой интранатальной гипоксии его введение не оправдано.
Реанимацию в родильном зале прекращают, если в течение 20 мин после рождения на фоне проведения адекватных реанимационных мероприятий у ребенка не восстанавливается сердечная деятельность.
Положительный эффект от реанимационных мероприятий, когда в течение первых 20 мин жизни восстанавливаются адекватное дыхание, нормальная ЧСС и цвет кожных покровов, служит основанием для прекращения реанимации и перевода ребенка в отделение интенсивной терапии и реанимации для последующего лечения. Туда же переводятся и пациенты с неадекватным самостоятельным дыханием, шоком, судорогами и разлитым цианозом. При этом искусственная вентиляция легких, начатая в родильном зале, не прекращается. В отделении реанимации и интенсивной терапии проводят комплексное лечение по принципам интенсивной посиндромной терапии.
Как правило, основную массу пациентов отделения реанимации и интенсивной терапии составляют маловесные, недоношенные с очень низкой и экстремально низкой массой тела, а также доношенные дети в критическом состоянии, при котором утрачена или значительно нарушена одна или несколько жизненно важных функций организма, что требует либо их искусственного восполнения, либо существенной терапевтической поддержки.
Расчеты показывают, что на каждую 1000 беременностей, завершившихся родами, реанимационно-интенсивная помощь требуется в среднем 100 новорожденным. Потребность в реанимационно-интенсивных койках при условии занятости коечного фонда на 80—85% и продолжительности пребывания на койке от 7 до 10 дней составляет 4 койки на каждую 1000 живорожденных детей.
|
|
|
Существует и другой вариант расчета в зависимости от численности населения: при населении 0,25; 0,5; 0,75; 1,0 и 1,5 млн. потребность в реанимационных койках для новорожденных составляет соответственно 4; 8; 11; 15 и 22, а во врачах для оказания круглосуточной помощи — 1; 1,5; 2; 3; 4. Опыт показывает, что нецелесообразно содержать малокоечные, маломощные отделения реанимации и интенсивной терапии.
Оптимальный коечный состав 12—20 мест, при этом одна треть — реанимационные и две трети — интенсивные койки.
При организации отделения реанимации и интенсивной терапии новорожденных должен быть предусмотрен следующий набор помещений: реанимационно-интенсивные залы, изоляторы, экспресс-лаборатория, комнаты для врачебного, сестринского персонала, для родителей и для хранения медицинской аппаратуры. Обязательно выделение санитарной зоны, а также зоны для обработки и проверки работоспособности аппаратуры.
Очень важно разработать «грязный» и «чистый» маршруты для движения аппаратуры и посетителей.
Современные нормативы площади на одно реанимационно-интенсивное место составляют от 7,5 до 11 м2. В оптимальном варианте целесообразно иметь еще по 11 м2 площади на каждое реанимационное место для хранения аппаратуры и расходного материала.
Основой лечебного места служит инкубатор — минимум 1,5 л на одно место для пациента. Соотношение стандартных и интенсивных (серво-контроль, двойная стенка) моделей инкубаторов 2:1.
Комплект лечебной аппаратуры на каждое место состоит из респиратора для длительной ИВЛ, отсоса для аспирации слизи, двух инфузионных насосов, лампы для фототерапии, наборов для реанимации, дренирования плевральных полостей, заменного переливания крови, катетеров (желудочных, пупочных), наборов игл-»бабочек» и подключичных катетеров.
Кроме того, в отделении должны быть реанимационный стол с источником лучистого тепла и сервоконтролем, компрессоры для обеспечения сжатым воздухом и кислородные установки.
В комплект диагностической аппаратуры на каждое рабочее место входят:
1) монитор слежения за частотой сердцебиения и дыхания;
2) монитор для контроля артериального давления;
3) монитор для транскутанного определения напряжения кислорода и углекислого газа в крови;
4) пульсооксиметр для мониторинга насыщения гемоглобина кислородом;
5) температурный монитор.
Необходим также общий на отделение набор диагностических приборов, включающий транскутанный билирубинометр (типа «Билитест-М») для определения и мониторирования уровня билирубина бескровным способом, прибор типа «Билимет» для определения билирубина микрометодом в крови, аппараты для определения КОС, электролитов, глюкозы, гематокритную центрифугу, портативный рентгеновский аппарат, ультрасонографический аппарат, трансиллюминатор.
Важным элементом организации отделения реанимации и интенсивной терапии новорожденных является штатное расписание (врач анестезиолог-реаниматолог из расчета 1 круглосуточный пост на 6 коек в отделении реанимации и интенсивной терапии новорожденных). Минимальное расписание включает пост медицинских сестер (4,75 ставки) на 2 койки, пост врачебный (4,75 ставки) — на 6 коек, пост младших медицинских сестер (4,75 ставки) — на 6 коек. Кроме того, должны быть предусмотрены должности заведующего отделением, старшей медицинской сестры, процедурной медицинской сестры, врача-невропатолога, врача-лаборанта и 4,5 ставки лаборантов для круглосуточного обслуживания экспресс-лаборатории.
Зарубежный опыт показывает, что оптимальным для отделения реанимации и интенсивной терапии новорожденных является следующий количественный врачебный состав: на 4 койки 5 ставок врача; на 8 — 7,5; на 11 — 10; на 15 — 15; на 22 - 20 врачей.
Соотношение медицинских сестер к больным, находящимся в критическом состоянии, 1:1, а для пациентов, требующих интенсивной терапии, 1:3. На 20 реанимационно-интенсивных коек требуется 50 медицинских сестер. Важно предусмотреть так называемую кофейную медицинскую сестру, которая в случае необходимости может подменить свою коллегу при ее кратковременных вынужденных отлучках.
Показания к поступлению в отделение реанимации и интенсивной терапии новорожденных.
1. Респираторные нарушения (синдром дыхательных расстройств, мекониальная аспирация, диафрагмальная грыжа, пневмоторакс, пневмония).
2. Низкая масса тела при рождении (2000 г и менее).
3. Тяжелая неонатальная инфекция бактериальной и вирусной этиологии.
4. Тяжелая асфиксия при рождении.
5. Судорожный синдром, церебральные нарушения, включая внутричерепные кровоизлияния.
6. Метаболические нарушения, гипогликемия, электролитные нарушения и др.
7. Сердечно-сосудистая недостаточность. При указанных ситуациях речь, как правило, идет о пациентах, состояние которых определяется как тяжелое или критическое.
Однако во всех родовспомогательных учреждениях всегда имеется достаточно большая группа новорожденных с высоким риском перинатальной патологии (это высокий показатель страдания плода, отягощенный акушерский анамнез у матери, летальные исходы для плода и новорожденного при предыдущих беременностях) и с нетяжелыми формами соматических и неврологических заболеваний.
Для таких пациентов должен быть развернут блок (пост) группы высокого риска. Разделение потоков новорожденных позволяет улучшить качество лечения, открывает возможность для маневра в неординарных ситуациях.
Как известно, большую долю в структуре перинатальной заболеваемости и смертности составляет патология, которая в отчетной документации формулируется как «внутриматочная гипоксия и асфиксия при рождении». Другими словами, у большинства больных новорожденных наблюдается симптомокомплекс нарушения мозгового кровообращения. Поэтому включение невропатолога в штат отделения интенсивной помощи новорожденным становится совершенно необходимым.
Долечивание, выхаживание и первичная реабилитация новорожденных, оставшихся живыми в экстремальных условиях патологии неонатального периода, проводят в отделении патологии доношенных и недоношенных новорожденных, откуда большая часть пациентов уходит домой. Наблюдение за ними продолжает консультативная поликлиника перинатального центра, завершая цикл оказания перинатальной помощи.
Перинатальная смертность
Объективная информация об уровне и структуре перинатальной патологии и ее динамике является основой для сравнительного анализа состояния здоровья новорожденных, а также планирования материальных и кадровых ресурсов при осуществлении необходимых лечебно-оздоровительных мероприятий. К перинатальной патологии принято относить патологические состояния плода и новорожденного, выявленные в перинатальном периоде независимо от срока их возникновения.
Для получения сопоставимых статистических данных при изучении указанного вида патологии необходимы единые методические подходы к их учету. Одним из инструментов обеспечения сопоставимости материалов о здоровье населения, распространенности отдельных видов патологии как в пределах одной страны, так и в международном масштабе, является Международная статистическая классификация болезней и проблем, связанных со здоровьем (МКБ-10, 1995).
В опубликованной в России МКБ-10 (Женева, 1995) перинатальная патология представлена самостоятельным XVI классом — «Отдельные состояния, возникающие в перинатальном периоде»; в ней содержатся также стандарты и требования к регистрации мертворождений, перинатальной, неонатальной и младенческой смертности.
Перинатальный период начинается с 22-й полной недели (154-го дня) внутриутробной жизни плода (в это время в норме масса тела плода составляет 500 г) и заканчивается спустя 7 полных дней после рождения.
Для международной сопоставимости страны должны представлять в ВОЗ статистические данные, в которых числитель и знаменатель всех показателей и соотношений ограничивается только плодами и младенцами с массой тела 1000 г и более; при отсутствии информации о массе указывают срок беременности (28 полных недель) или длину тела (35 см от верхушки темени до пяток). Потери рожденных с массой тела 500—999 г рекомендовано учитывать на уровне национальной статистики.
Российская Федерация, выполняя данные рекомендации, представляет информацию, содержащуюся в отчетной статистической форме учреждений родовспоможения № 32. При учете перинатальных потерь государственная статистика руководствуется приказом МЗ РФ № 318 от 04.12.92 г. и постановлением Госкомстата РФ № 190 от 04.12.92 г.
Особенность данного вида патологии состоит в многофакторности влияния на состояние плода и новорожденного, длительности беременности, экстрагенитальной и акушерской патологии матери, а также динамики развития самого плода. Это необходимо учитывать как при анализе уровня, структуры и причинно-следственных связей перинатальной патологии, так и при разработке мер по ее профилактике.
Для разработки мер профилактики перинатальной патологии на уровне административной территории целесообразно использовать обобщенные наименования патологических состояний матери и плода (родовая травма; дыхательные и сердечно-сосудистые нарушения, возникающие в перинатальном периоде; инфекции, специфичные для перинатального периода, и др.; поражения плода и новорожденного, обусловленные состояниями матери, не связанными с настоящей беременностью, и др.). Детальные группировки перинатальной патологии необходимы для углубленного изучения ее отдельных форм (родовая травма: родовая травма ЦНС, родовая травма скелета и др.).
Для отражения многофакторности перинатальной патологии при ее анализе целесообразно создавать перекрестные таблицы, в которых по вертикали обозначают факторы материнского происхождения, осложнения беременности, родов, послеродового периода; по горизонтали — поражения плода и новорожденного. Влияние длительности беременности, особенностей физического развития плода при указанном перекрестном сочетании материнских и плодовых поражений можно отразить в таблицах, построенных отдельно для доношенных, недоношенных, маловесных, в соответствии с гестационным сроком и т. д.
При таком подходе удается получить комплексную информацию о перинатальной патологии, включающую физическое развитие ребенка, состояние здоровья матери, особенности течения беременности и родов.
С учетом изложенных выше общих принципов методологии изучения перинатальной патологии ниже более детально рассмотрены вопросы, касающиеся перинатальной смертности.
Перинатальная смертность включает мертворождаемость (смерть наступила до родов или в родах) и раннюю неонатальную смертность (смерть наступила в течение 168 ч после рождения ребенка). Показатель вычисляют по отдельным административным территориям (республика, область, край, город, район) за календарный год, 6 мес, квартал согласно общепринятой методике. Методика расчета перинатальной смертности и ее компонентов приведена ниже.

Мертворождаемость состоит из двух компонентов: антенатальной (смерть наступила до начала родовой деятельности) и интранатальной (смерть наступила в родах). Ниже приведен расчет этих показателей.
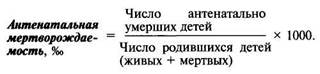

С помощью указанных интенсивных показателей можно оценить уровень (частоту, распространенность) мертворождений, смерти детей в раннем неонатальном и перинатальном периодах среди популяционных групп всех родившихся и детей, родившихся живыми, в том числе недоношенными, а также качество медицинской помощи беременным, роженицам и новорожденным. Показатели позволяют сравнить уровень мертворождаемости, ранней неонатальной и перинатальной смертности на разных административных территориях.
Динамика показателя перинатальной смертности свидетельствует о качестве медицинской помощи. Вместе с тем этот показатель в родовспомогательных учреждениях не всегда позволяет сравнить их деятельность в связи со специализацией отдельных учреждений из-за различия контингента беременных (преждевременные роды, беременные и роженицы с диабетом, сердечно-сосудистой патологией), а также из-за недостоверности данных при малом числе наблюдений (где величина показателя перинатальной смертности не превышает свою ошибку в 3 раза и более).
При росте показателей антенатальной или интранатальной мертворождаемости или значительных изменениях их соотношения крайне важно проводить детальный клинический анализ и выяснять причины, поскольку эти факты могут свидетельствовать об ослаблении внимания к антенатальной охране плода в женской консультации или к тактике ведения родов и реанимационной помощи новорожденным в акушерском стационаре.
Показатель перинатальной смертности принято анализировать отдельно для доношенных и недоношенных детей, что обусловлено различием в их состоянии и адаптационных возможностях после рождения, а также разными требованиями к акушерской и неонатологической службе при оказании медицинской помощи таким детям.
При определении доношенности, недоношенности плода (новорожденного) следует принимать во внимание продолжительность беременности и учитывать рост плода (новорожденного), массу, а также другие признаки, характеризующие его (новорожденного) зрелость.
Основные параметры физического развития при рождении в зависимости от гестационного возраста и высоты стояния дна матки (М±а) представлены в табл. 1.8.
Заключение о зрелости или незрелости плода дают педиатр и акушер-гинеколог родильного дома (отделения), что документируется в истории развития новорожденного и истории родов.
Таблица 1.8. Основные параметры развития плода в зависимости от срока беременности и высоты стояния дна матки*
| Срок беременности, нед | Масса тела, г (М+о) | Длина тела, см (М±<т) | Высота стояния дна матки над лобком, см |
| 500 ± 35 | 25 ± 1,2 | 22,7 | |
| 650 ± 37 | 27 + 1,3 | 23,4 | |
| 800 ± 40 | 29,9 ± 1,1 | 24,2 | |
| 820 + 47 | 31,7 ± 1,4 | 25,2 | |
| 900 ± 52 | 32,9 ± 1,8 | 26,0 | |
| 934 ± 76 | 34,8 ± 1,8 | 27,2 | |
| 1124 ± 183 | 35,9 ± 1,8 | 28,5 | |
| 1381 ± 172 | 37,9 ± 2,0 | 29,6 | |
| 1531 + 177 | 38,9 ± 1,7 | 29,9 | |
| 1695 ± 212 | 40,4 ± 1,6 | 30,7 | |
| 1827 ± 267 | 41,3 ± 1,9 | 31,5 | |
| 2018 + 241 | 42,7 ± 1,8 | 32,6 | |
| 2235 ± 263 | 43,6 + 1,7 | 33,5 | |
| 2324 ± 206 | 44,4 ± 1,5 | 33,9 | |
| 2572 + 235 | 45,3 ± 1,7 | 34,2 | |
| 2771 ± 418 | 47,6 + 2,3 | 35,5 | |
| 3145 ± 441 | 49,6 ± 2,0 | 35,0 | |
| 3403 ± 415 | 50,8 + 1,6 | 35,7 | |
| 3546 ± 457 | 51,7 ± 1,1 | 36,0 |
* Шкала составлена по материалам Г. М. Дементьевой, В. В. Коротковой (1981) и Е. И. Николаевой (1983).
Выборочными данными установлена четкая зависимость уровня перинатальной смертности, мертворождаемости, ранней неонатальной смертности от массы тела при рождении.
Наиболее высокие показатели перинатальной смертности характерны для детей с массой тела до 1500 г (от 300 до 400 на 1000 родившихся). В последующих весовых группах перинатальная смертность заметно снижается. Показатели перинатальной смертности при массе тела плода от 3000 до 3500 г минимальны (3— 7%о). Эта закономерность наблюдается как при мертворождении, так и при ранней неонатальной смертности.
Анализ динамики показателя перинатальной смертности для различных весовых групп свидетельствует, что за период 1999—2003 гг. наиболее выражена тенденция к ее снижению у маловесных детей (с массой тела при рождении до 2500 г). Этот факт говорит об улучшении неонатальной помощи недоношенным и маловесным, однако следует учесть, что именно среди этих детей значительное число умирает в течение первого месяца жизни (неонатальная смертность).
Преобладание доношенных детей среди перинатальных потерь является крайне неблагоприятным фактором. Социальная значимость этих потерь особенно велика, поскольку теряются функционально сформированные, зрелые дети.
Величина показателя перинатальной смертности в определенной мере зависит от уровня материально-технического оснащения акушерских стационаров и методов антенатальной охраны плода. Так, анализ статистики перинатальной смертности по ряду территорий свидетельствует, что при внедрении современных методов слежения за состоянием плода уровень данного показателя значительно снижается.
Для оценки уровня оказания акушерской, реанимационной и интенсивной помощи новорожденным имеет значение структурное соотношение мертворождаемости и ранней неонатальной смертности среди всех перинатальных потерь.
Увеличение доли мертворожденных при одном и том же уровне перинатальных потерь может указывать на недостаточную антенатальную охрану плода, недочеты в ведении родов и реанимационной помощи новорожденным.
По данным ВОЗ (Perinatal Mortality, Geneva, 1996—1997), в развитых странах доля мертворожденных среди перинатальных потерь составляет 45,8%, для развивающихся — 56,1%. За последние 5 лет в РФ это значение колеблется в пределах 50-54,5%.
В зависимости от времени наступления смерти в показателях мертворождаемости выделяют антенатальную (до начала родовой деятельности) и интранатальную (в родах) смерть плода. При анализе мертворождаемости имеют значение абсолютная величина потерь, интенсивные показатели (их рассчитывают делением числа мертворожденных, умерших антенатально или интранатально, на число всех родившихся и умножением на 1000) и их соотношение. Рост показателей мертворождаемости в антенатальном или интранатальном периоде, значительные изменения в их соотношении требуют детального рассмотрения для принятия правильного решения по организации лечебного процесса.
Относительно низкие показатели интранатальной мертворождаемости достигнуты при внедрении в акушерскую практику мониторного контроля в родах, расширении показаний к кесареву сечению в интересах плода, использовании современных методов при ведении родов у женщин с высоким риском перинатальной патологии.
Для разработки мер профилактики перинатальной смертности большое значение имеет детальный анализ ее причин.
Основное заболевание (патологоанатомический диагноз), явившееся причиной смерти ребенка, анализируют по нозологическому принципу раздельно в группах мертворожденных и умерших новорожденных. При этом учитывают только основное заболевание, представленное одной нозологической формой, которое само непосредственно или через присоединившиеся осложнения приводит к смерти плода и новорожденного. Если имеются два или более конкурирующих или сочетанных заболеваний, учитывают лишь одно из них, исходя при этом из возможности излечивания заболевания и его социальной значимости.
Для разработки мер профилактики перинатальной смертности целесообразно каждый случай смерти разбирать с точки зрения ее предотвратимости. Большинство исследователей делят все случаи перинатальной смертности на предотвратимые, условно предотвратимые и непредотвратимые.
Предотвратимыми случаями, составляющими от 25 до 40%, считают такие, причину которых можно было устранить путем не только врачебного наблюдения за беременной в женской консультации, но и специальной акушерской и лечебной помощи беременной и роженице в родильном доме, а также правильным выбором тактики лечения новорожденного, своевременным переводом детей в специализированные отделения для недоношенных и больных новорожденных и др.
К случаям смерти, причину которой в настоящее время трудно устранить, относят уродства плода, пуповинную и плацентарную патологию, глубокую недоношенность новорожденных. Мероприятия по устранению этих причин во многом связаны с дальнейшим развитием фундаментальных исследований и материально-технического оснащения родовспомогательных учреждений. Таким образом, сопоставимость информации о перинатальной патологии, ее достоверность во многом определяются единством методологии ее получения, корректностью использования соответствующих разделов МКБ-10.
При анализе причин можно рассчитать долю каждого заболевания среди всех заболеваний (в процентах к итогу), а также частоту смерти от каждого заболевания (делением числа умерших от каждого заболевания на всех родившихся и умножением результатов на 1000). По доле каждого заболевания можно судить о его роли в структуре причин перинатальной смертности. Динамика частоты заболевания свидетельствует об эффективности мер профилактики и лечения.
В структуре причин в целом ведущее место занимают внутриматочная гипоксия (асфиксия) в родах. Доля этой причины колебалась от 38,45 до 43,49%, при этом четкой тенденции к снижению или увеличению ее не наблюдалось. Второй по значимости причиной перинатальной смертности является синдром респираторных расстройств и другие респираторные состояния. Доля их в структуре причин перинатальной смертности имеет тенденцию к снижению (с 19,4% в 1991 г. до 16,0% в 1996 г.), что можно объяснить внедрением новых технологий в отделениях реанимации и выхаживания маловесных детей.
На третьем месте среди причин перинатальной смертности находятся врожденные аномалии развития, доля которых возрастает. Своевременная (до 28 нед беременности) и тщательная антенатальная диагностика позволила бы снизить значимость этой патологии в структуре причин перинатальной смертности и привести к снижению самого показателя.
Возрастает роль в структуре причин перинатальной смертности врожденной пневмонии и инфекций, специфических для перинатального периода. Снижение доли родовой травмы можно в значительной мере объяснить расширением показаний к абдоминальному родоразрешению, в том числе и в интересах плода. Снижение уровня перинатальной смертности с увеличением частоты кесарева сечения происходит лишь до определенного момента. Согласно рекомендации ВОЗ, увеличение частоты этой операции более 10% нецелесообразно. По мнению ряда авторов [Краснопольский В. И., Радзинский В. Е., 1993; Комиссарова Л. М., 1998; Gibbs R. S., 1985], оптимальный уровень кесарева сечения составляет от 10 до 15%.
Анализируя причины смерти детей в перинатальном периоде, обусловленные состоянием матери, можно сказать, что за последние 5 лет в их структуре произошли некоторые изменения. Среди причин, приводящих к антенатальной смерти плода, удалось снизить число тяжелых форм поздних гестозов беременных. Несмотря на рост частоты этого осложнения беременности, в последние годы снижение его роли в антенатальных потерях связано со своевременной госпитализацией женщин, правильной тактикой в отношении сроков родоразрешения в зависимости от эффективности лечения. В то же время возросло значение экстрагенитальной патологии, в том числе эндокринной, которая в сочетании с угрозой невынашивания беременности приводит к ФПН. Не снижаются перинатальные потери и в связи с преждевременной отслойкой плаценты. Основной причиной перинатальных потерь в настоящее время остается патология плаценты и пуповины, диагностика и лечение которой на данном этапе развития перинатологии затруднены.
Увеличивается роль инфекционных заболеваний матери, в связи с чем встает вопрос как о микробиологическом и вирусологическом обследовании беременных, так и о подготовке к беременности женщин, потерявших ребенка в связи с внутриутробным инфицированием.
Как установлено нашими исследованиями, более низкий уровень перинатальной смертности может быть достигнут только включением современных методов в систему динамического наблюдения беременных и деятельность акушерского стационара. Внедрение скрининг-программы 3-кратного УЗИ (10—14 нед, 10—24 нед, 32— 34 нед); осмотр окулиста; оториноларинголога; по показаниям — других специалистов; контроль за динамикой содержания Э3, ПЛ и ХГ; оценка показателей кардиотокографии плода, проведение биохимических, микробиологических и вирусологических исследований; гормональная кольпоцитология; тонусометрия матки, а также своевременное устранение выявленных отклонений — все это дает возможность снизить в 1,5 раза преждевременные роды, более чем на 100%о — заболеваемость новорожденных и на 30% — перинатальную смертность, причем мертворождаемость больше, чем раннюю неонатальную смертность.
Опыт зарубежных стран и ряда учреждений нашей страны свидетельствует о том, что организация перинатальных центров с концентрацией в них беременных высокого риска перинатальной патологии, современной аппаратуры, квалифицированных кадров, с развитой интенсивной помощью беременным и новорожденным позволяет снизить перинатальную смертность на 25— 30% среди беременных высокого риска. Поэтому для нашей страны на данном этапе развития акушерской помощи наиболее рациональной организационной формой является перинатальный центр, который предназначается для оказания амбулаторной, стационарной помощи же
|
|
|


