 |
Серная (сульфатная) кислота и ее соли.
|
|
|
|
Кислород и сера.
План.
- Общая характеристика подгруппы. Кислород как химический элемент.
- Кислород как простое вещество.
- Озон.
- Сера как химический элемент.
- Сера как простое вещество.
- Соединения серы с отрицательной степенью окисления.
- Оксиды серы.
- Серная кислота и ее соли.
Главную подгруппу 6 группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы имеют на внешнем валентном слое конфигурацию типа s2p4 , т.е. близкую к завершению. Это обуславливает окислительные способности этих элементов. Следует отметить, что их ЭО при переходе от кислорода к теллуру резко снижается, т.к. появление новых электронных слоев ведет к увеличению радиуса атомов. Наибольшей окислительной способностью обладают типичные неметаллы - кислород и сера.
Кислород как химический элемент. Кислород или Оксиген №8. 2 период, 6 группа, главная подгруппа.
Состав атома:8р, 8е-, 8n.
Схема строения: заряд ядра +8, два электронных слоя (2 е-, 6 е-)
Электронная и графическая формулы: 1s22s22p4
 Типичный неметалл, сильный окислитель. Практически единственная степени окисления: -2, исключение – пероксиды.
Типичный неметалл, сильный окислитель. Практически единственная степени окисления: -2, исключение – пероксиды.
Практически единственная валентность: II.
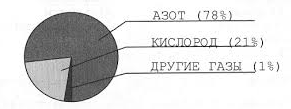
Кислород самый распространенный элемент на Земле. На его долю приходится почти половина массы земной коры и около 90% массы мирового океана. Встречается в свободном состоянии в виде двух аллотропных модификаций: кислород О2 и озон О3. Эти газы входят в состав атмосферы, кислород в нем составляет около 21% по объему, озон – доли процента. Входит в состав неорганических соединений оксидов и гидроксидов, а также в состав многих солей. Содержится в важнейших органических соединениях: спиртах, альдегидах, кислотах и сложных эфирах. Является органогеном, входит в состав белков, жиров и углеводов, нуклеотидов и т.д.
|
|
|
2. Физические свойства кислорода. При н.у. это бесцветный газ, не имеющий запаха. Температура кипения кислорода (-183оС). Немного тяжелее воздуха, немного растворим в воде (в 100 объемах воды - около 5 объемов кислорода при 0оС). Жидкий кислород притягивается магнитом.
Химические свойства кислорода. Кислород во всех химических реакциях проявляет сильные окислительные свойства. Его бинарные соединения с элементами называются оксидами. Кислород образует оксиды со всеми элементами, кроме гелия, неона и аргона. Оксиды образуются при окислении простых веществ (непосредственно не взаимодействуют с кислородом только галогены, золото и платина), при окислении сложных веществ. Реакции взаимодействия веществ с кислородом часто сопровождаются выделением тепла и света и поэтому их называют горением. При горении веществ на воздухе выделяется такое же количество тепла, но часть его тратится на нагревание азота, входящего в состав воздуха, поэтому температура пламени значительно снижается. Оксиды могут образовываться и при разложении сложных веществ (гидроксидов и солей), эти реакции, наоборот, обычно идут с поглощением энергии.
P0 + O20 => P2+5O5-2
S + O2 => SO2
Mg + O2 => MgO
Fe + O2 => Fe2O3
CH4 + O2 => CO2 + H2O
ZnS+ O2 => ZnO + SO2
Cu(OH)2 => CuO + H2O
CaCO3 =>CaO + CO2
Роль в природе: процессы дыхания, гниения по химической сути являются процессами окисления сложных органических веществ.
Применение: Как сырье для получения различных соединений; для интенсификации процессов в химической и металлургической промышленности; для получения высоких температур (сварка и резка металла, ракетное топливо); жидкий кислород в смеси с опилками или другими горючими веществами используют как взрывчатое вещество (ВВ); газообразный кислород используют в медицине для лечения различных заболеваний (оксигенотерапия).
|
|
|
3. Озон. При н.у. это газ, обладающий характерным запахом. Температура кипения озона (-112оС). Он тяжелее воздуха, растворим в воде (в 100 объемах воды - около 50 объемов озона при 0оС).
Озон образуется из кислорода при пропускании через него электрического разряда или жесткого УФ излучения.
О2 => O3
Обратная реакция – превращение озона в кислород – протекает самопроизвольно, т.е. озон неустойчивое соединение. Озон – один из сильнейших окислителей (точнее этим окислителем является атомарный кислород, который образуется при распаде озона), при взаимодействии озона с веществами тоже образуются оксиды, но реакции протекают более энергично, чем с кислородом. Как сильный окислитель озон убивает бактерии и применяется для обеззараживания воды и помещений. Озон ядовит, ПДК в воздухе 10-5%, при этой концентрации хорошо ощущается его запах. В верхних слоях атмосферы концентрация озона обычно лежит в пределах 10-7-10-6.
Оксиды- один из важнейших классов неорганических веществ. Они делятся на основные, кислотные и амфотерные оксиды. Все они образуют гидроксиды и соответствующие соли. Кислород входит также в состав большого количества органических соединений.
 Роль кислорода в организме и использование кислорода и озона в медицине. Содержание кислорода в организме 62,43%. Взрослый человек потребляет 264 см3 кислорода в мин. Оксиген имеет исключительное биологической значение, от него зависят важнейшие биохимические процессы, он участвует во всех видах обмена веществ. Наиболее известный физиологический процесс с участием кислорода – дыхание. Этот сложный физиологический процесс включает в себя не только процесс газообмена в легких, но и транспорт кислорода с током крови от легких к клеткам. Именно там в митохондриях происходит процесс тканевого дыхания, т.е. процесс окисления органических веществ. Продукты окисления (СО2) кровь уносит к легким. А энергия, которая выделяется в процессе реакции окисления тратится на образование молекул АТФ. При гидролизе АТФ энергия снова выделяется и расходуется на нужды организма. Т.е. с участием кислорода проходят все окислительные реакции в организме, за счет энергии этих реакций протекают все физиологические процессы. С кислородом связаны также фагоцитарные функции организма. Вспомните особенности строения атома кислорода. У него ярко выраженные неметаллические, окислительные свойства. В медицинской практике используются не только множество соединений кислорода (оксидов, гидроксидов, кислот, солей, органических и неорганических соединений) но и простые вещества – кислород и озон. Оксигенотерапия – кислородом лечат гельминтозы, сердечно-сосудистые и инфекционные заболевания, он стимулирует работу нервной системы, обладает снотворным действием и т.д. Оксигенотерапия лежит в основе климатолечения. Оксигенобаротерапия – метод лечения, в котором используется дыхание воздушной смесью с повышенным содержанием кислорода, в специальных герметичных помещениях (барокамерах). В озонотерапии используют озон. Озон обладает бактерицидным, дезодорирующим действием; используется для обработки питьевой воды, помещений, белья; в смеси с кислородом используется для лечения различных заболеваний.
Роль кислорода в организме и использование кислорода и озона в медицине. Содержание кислорода в организме 62,43%. Взрослый человек потребляет 264 см3 кислорода в мин. Оксиген имеет исключительное биологической значение, от него зависят важнейшие биохимические процессы, он участвует во всех видах обмена веществ. Наиболее известный физиологический процесс с участием кислорода – дыхание. Этот сложный физиологический процесс включает в себя не только процесс газообмена в легких, но и транспорт кислорода с током крови от легких к клеткам. Именно там в митохондриях происходит процесс тканевого дыхания, т.е. процесс окисления органических веществ. Продукты окисления (СО2) кровь уносит к легким. А энергия, которая выделяется в процессе реакции окисления тратится на образование молекул АТФ. При гидролизе АТФ энергия снова выделяется и расходуется на нужды организма. Т.е. с участием кислорода проходят все окислительные реакции в организме, за счет энергии этих реакций протекают все физиологические процессы. С кислородом связаны также фагоцитарные функции организма. Вспомните особенности строения атома кислорода. У него ярко выраженные неметаллические, окислительные свойства. В медицинской практике используются не только множество соединений кислорода (оксидов, гидроксидов, кислот, солей, органических и неорганических соединений) но и простые вещества – кислород и озон. Оксигенотерапия – кислородом лечат гельминтозы, сердечно-сосудистые и инфекционные заболевания, он стимулирует работу нервной системы, обладает снотворным действием и т.д. Оксигенотерапия лежит в основе климатолечения. Оксигенобаротерапия – метод лечения, в котором используется дыхание воздушной смесью с повышенным содержанием кислорода, в специальных герметичных помещениях (барокамерах). В озонотерапии используют озон. Озон обладает бактерицидным, дезодорирующим действием; используется для обработки питьевой воды, помещений, белья; в смеси с кислородом используется для лечения различных заболеваний.
|
|
|
4. Сера как химический элемент. Сульфур №16. 3 период,6 группа, главная подгруппа.
Состав атома: 16р, 16е-, 16n.
Схема строения: заряд ядра +16, три электронных слоя (2 е-, 8 е-, 6 е-)
Электронная и графическая формулы:
Типичный неметалл. Характерные степени окисления: +6 и -2, возможна +4.
Возможные валентности: II, IV, VI.
Широко распространена в природе, содержание в земной коре 0,1%. Встречается в свободном состоянии (самородная сера) и в виде соединений. Например: сульфидов (железный колчедан FeS2, свинцовый блеск PbS) и сульфатов (гипс CaSO4∙2H2O, глауберова соль Na2SO4∙10H2O). Органоген, входит в состав белка.

 5. Сера как простое вещество. Для серы характерна аллотропия. Три модификации. Сера ромбическая: твердое вещество желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 112,8оС, плотность 2,07 г/см3. Нерастворима в воде, не смачивается. Растворяется в бензоле. Сера моноклинная: твердое вещество темно-желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 119,3оС, плотность 1,96г/см3. При н.у. неустойчива, превращается в ромбическую. Сера пластическая: резиноподобная коричневая масса, аморфное строение, S∞. При н.у. неустойчива, превращается в ромбическую.
5. Сера как простое вещество. Для серы характерна аллотропия. Три модификации. Сера ромбическая: твердое вещество желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 112,8оС, плотность 2,07 г/см3. Нерастворима в воде, не смачивается. Растворяется в бензоле. Сера моноклинная: твердое вещество темно-желтого цвета, молекулярная кристаллическая решетка, S8, плавится при 119,3оС, плотность 1,96г/см3. При н.у. неустойчива, превращается в ромбическую. Сера пластическая: резиноподобная коричневая масса, аморфное строение, S∞. При н.у. неустойчива, превращается в ромбическую.
|
|
|
Химические свойства: типичный неметалл, может быть и окислителем, и восстановителем.
 Как окислитель взаимодействует с металлами и водородом:
Как окислитель взаимодействует с металлами и водородом:
Al + S→ Al2S3
Na + S → Na2S
H2 + S → H2S
Как восстановитель – с активными неметаллами:
S + O2 →SO2
Получение:
1). Самородная сера. Перегретым водяным паром обрабатывают породу.
2). Разложение пирита без доступа воздуха: FeS2 → FeS + S
 3). Неполное сгорание сероводорода: H2S + O2 → S + H2O
3). Неполное сгорание сероводорода: H2S + O2 → S + H2O
Применение:
1). Получение серной кислоты и сульфатов.
2). Получение сульфитов.
3). Производство красителей, резины, черного пороха, спичек, лекарств.
Сера в организме человека и ее использование в медицине.
Содержание в организме 0,16%, суточная потребность 4-5 грамм. Больше всего серы содержится в кератине волос, костях, нервной ткани; входит в состав белков (аминокислоты цистеин и метионин), гормонов, витаминов. В организме серная кислота, образующаяся в процессе метаболизма, обезвреживает ядовитые продукты метаболизма (фенол, скатол, крезол) и чужеродные токсины (тяжелые металлы). Простое вещество сера оказывает противомикробное и противопаразитарное действие, серные мази и суспензии используют для лечения кожных заболеваний, гельминтозов. 1% раствор серы в персиковом масле (сульфозин) используют при лечении шизофрении и алкоголизма. Тиосульфат натрия обладает противовоспалительным и противоаллергическим действием.
6. Соединения серы с отрицательной степенью окисления (-2). H2S - сероводород, бесцветный газ с характерным запахом гниющего белка. Кристаллизуется при -85,7оС, кипит при -60,8оС. Немного тяжелее воздуха, при н.у. в 1л воды растворяется 2,5 л сероводорода. Восстановитель, окисляется кислородом воздуха (горение).
H2S+ O2 →SO2+ H2O, при недостатке кислорода или низкой температуре H2S+ O2 →S+ H2O
Водный раствор называют сероводородной водой, на воздухе, на свету она становится мутной (опалесцирует) в результате образования коллоидного раствора серы в воде (см. предыдущую реакцию). Кроме того, раствор сероводорода обладает свойствами кислоты, поэтому его называют сероводородной кислотой, это слабая кислота. Образуется при гниении белков, встречается в водах минеральных источников и вулканических газах.



 Такие источники могут быть причиной гибели человека (Сероводород очень ядовит!), но могут использоваться и для лечения желудка, почек, кожи. Соли сероводородной кислоты называют сульфидами. Большинство из них нерастворимо в воде. В природе эти соли образуют минералы, которые используют как руды цветных металлов: ZnS, CuS, PbS…Многие сульфиды имеют переменный состав. В легкой промышленности используют сульфиды натрия и кальция для очистки кожи от шерсти. Сульфиды щелочноземельных металлов служат основой люминофоров. А в лабораториях реакции образования сульфидов используют для определения многих металлов, т.к. эти соли имеют характерный цвет.
Такие источники могут быть причиной гибели человека (Сероводород очень ядовит!), но могут использоваться и для лечения желудка, почек, кожи. Соли сероводородной кислоты называют сульфидами. Большинство из них нерастворимо в воде. В природе эти соли образуют минералы, которые используют как руды цветных металлов: ZnS, CuS, PbS…Многие сульфиды имеют переменный состав. В легкой промышленности используют сульфиды натрия и кальция для очистки кожи от шерсти. Сульфиды щелочноземельных металлов служат основой люминофоров. А в лабораториях реакции образования сульфидов используют для определения многих металлов, т.к. эти соли имеют характерный цвет.
|
|
|
Оксиды серы.
SO2 - оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
Химические свойства: кислотный оксид, характерны восстановительные свойства.
Как восстановитель:
SO2 + O2 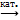 SO3, катализатор V2O 5
SO3, катализатор V2O 5
Как кислотный оксид сернистый газ взаимодействует со щелочами:
SO2+ NaОН →NaНSO3 и Na2SO3 + H2O (образуются соли: гидросульфиты и сульфиты).
С водою образуется сернистая (сульфитная) кислота.
SO2+ H2O ↔ H2SO3 Это слабый электролит. Нестойкая, существует только в водных растворах, легко окисляется кислородом воздуха до серной кислоты: H2SO3 + O2 → H2SO4.
Обесцвечивает органические красители.
 Получение:
Получение:
1). Горение серы: S + O2 →SO2
2). Обжиг сульфидов: ZnS + O2 → ZnO + SO2 и т.д.
Большое количество сернистого газа образуется при горении органических соединений (каменный уголь).
Применение:
1). Производство серной кислоты.
2). Производство сульфитов и гидросульфитов.
3). В с/х для уничтожения насекомых и микроорганизмов.
4). В текстильной промышленности для отбеливания тканей, соломки и т.д.
5). При консервировании фруктов и ягод.
SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
Химические свойства: сильный окислитель, кислотный оксид.
Как кислотный оксид:
SO3+ H2O →H2SO4 +Q, взаимодействует с водой, образуя серную кислоту, при этом выделяется большое количества тепла.
SO3+ NaОН →NaНSO4 и Na2SO4 + H2O, т.е. образует гидросульфаты и сульфаты
Получение: в промышленности SO2 + O2 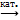 SO3, катализатор V2O 5
SO3, катализатор V2O 5
Применение: как промежуточный продукт при производстве серной кислоты, в лаборатории как сильное водопоглощающее средство.
Серная (сульфатная) кислота и ее соли.
H2SO4 – бесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,- нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
Химические свойства: 1. Сильная кислота, распадается на ионы по двум ступеням практически на 100%, образует два ряда солей.
H2SO4 ↔ H+ + HSO4- - гидросульфат –ион
HSO4- ↔ H+ + SO4 2- - сульфат- ион
Разбавленная кислота H2SO4 обладает всеми общими свойствами кислот: изменяет окраску растворов индикаторов); взаимодействует с основаниями, основными оксидами и солями (реакции ионного обмена, не ОВР!):
H2SO4+2 KOH → K2SO4+ 2 H2O;
2H+ +SO42- +2K+ + 2OH- = 2K++SO42- + 2H2O;
H++ OH- = H2O
H2SO4+ KOH → KНSO4+ H2O
3H2SO4+ Al2O3 → Al2(SO4)3+ 3 H2O;
2H+ +3SO42- + Al2O3 → 2Al3+ + 3SO42- + H2O;
2H+ + Al2O3 → 2Al3+ + H2O
H2SO4+ Na2CO3→ Na2SO4+ H2CO3 → Na2SO4+ H2O + CO2 ↑;
2H+ +SO42- + 2Na+ + CO3→ 2Na+ +SO42- + H2O + CO2 ↑;
2H+ +CO3→ H2O + CO2 ↑;
Во всех этих реакциях главную роль играют ионы водорода, а SO42- просто присутствует в растворе. Специфической реакцией иона SO42- (т.е. серной кислоты и всех ее солей) является реакция с солями бария.
H2SO4+ BaCl2 → 2HCl + BaSO4 ↓
2H+ + SO42-+ Ba2+ +2Cl- → 2H+ + 2Cl- + BaSO4 ↓
SO42-+ Ba2+ → BaSO4 ↓
Na2SO4+ Ba(NO3)2 → 2NaNO3+ BaSO4 ↓
2Na+ + SO42-+ Ba2+ +2NO3- → 2Na+ + 2NO3- + BaSO4 ↓
SO42-+ Ba2+ → BaSO4 ↓
Эту реакцию называют «качественной реакцией» на серную кислоту и ее соли, потому что в ней образуется характерный мелкокристаллический белый осадок BaSO4. Реакцию используют в лабораторной практике для определения наличия в растворе иона SO42-.
При взаимодействии с металлами серная кислота может вести себя по-разному, в зависимости от концентрации и активности металла.
В разбавленной H2SO4 окислителем является ион Н+, поэтому разбавленная серная кислота взаимодействует только с металлами, стоящими в ряду напряжений до водорода, причем, одним из продуктов реакции будет газ водород.
H2SO4(разб.)+ Zn → H2 ↑+ ZnSO4
Zn0 – 2e- → Zn+2H+ + e- → H0
Но если мы возьмем концентрированную кислоту, то в роли окислителя выступит S+6, и вместо водорода мы получим продукт ее восстановления – какое-то соединение серы. Какое? Это зависит от активности металла, температуры, концентрации кислоты. Обычно образуется смесь таких веществ. Но, немного упрощая, можно считать, что чем активнее металл, тем более глубоко идет процесс восстановления, и степень окисления серы в продукте реакции будет ниже. Следует также отметить, что с концентрированной H2SO4 взаимодействуют все металлы, кроме золота и платины, но на холоду железо, алюминий и хром пассивируются (не реагируют из-за образования прочной пленки на поверхности металла), а некоторые металлы не реагируют и с разбавленной серной кислотой (если при этом образуется нерастворимая соль).
 H2SO4(конц.)+ Zn → ZnSO4 + H2О + S Zn0 – 2e- → Zn2+ S+6 +6e- → S0
H2SO4(конц.)+ Zn → ZnSO4 + H2О + S Zn0 – 2e- → Zn2+ S+6 +6e- → S0
H2SO4(конц.)+ Cu → ZnSO4 + H2О + SO2 Cu0 – 2e- → Cu2+ S+6 +2e- → S+4
H2SO4(конц.)+ Ca → CaSO4 + H2О + CaSCa0 – 2e- → Ca2+ S+6 +8e- → S-2
H2SO4(конц.)– сильный окислитель, и может окислять не только металлы, но и неметаллы и даже их соединения, обугливает органические вещества (т.к. забирает воду, например, у углеводов)
H2SO4(конц.)+ C → СО2↑+ H2О + SO2↑
C0 – 4e- → C4+ S+6 +2e- → S+4
Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
1) обжиг колчедана (принцип теплообмена, в «кипящем слое», воздух обогащен кислородом):
FeS2 + O2 → Fe2O3 + SO2 + 13746кДж
2) каталитическое окисление сернистого газа (4500С, катализаторV2O 5 оксид ванадия (V), принцип противотока):
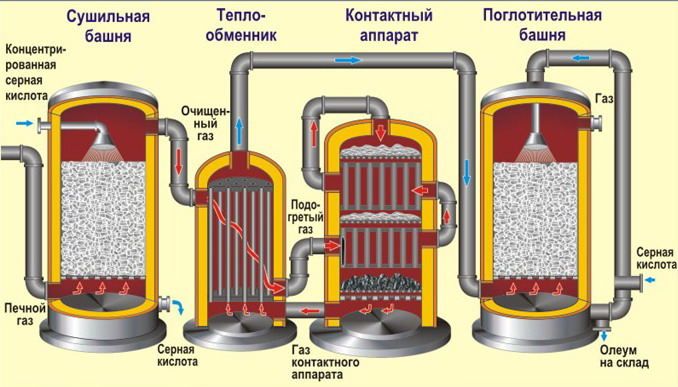 SO2 + O2 ↔ SO3 + 197,9кДж
SO2 + O2 ↔ SO3 + 197,9кДж
3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
SO3+ H2O →H2SO4 + 130,6 кДж
Конечным продуктом является «олеум» - раствор SO3 в концентрированной H2SO4.
В производстве серной кислоты часто используют сернистый газ, получаемый при обжиге цветных руд, горении топлива или свободной серы. Т.е. первая стадия может быть немного другой, а вот две последние – всегда одинаковы.
Применение. Серная кислота –«хлеб» химической промышленности.
1) получение сульфатов, которые широко используются в народном хозяйстве, например: K2SO4 и (NH4)2SO4 - сульфаты калия и аммония, вс/х как минеральные удобрения; CuSO4∙5H2O – медный купорос, в с/х как средство борьбы с болезнями растений, в легкой промышленности как краситель, в строительстве как противогрибковое средство, в гальванопластике (покрытие слоем меди); FeSO4∙ 7H2O – железный купорос, в с/х средство борьбы с вредителями растений, в легкой промышленности при крашении тканей.
CaSO4∙ 2H2O – минерал гипс, в строительстве используют «жженый гипс» 2CaSO4∙ H2O под названием «алебастр» в состав шпаклевок, в медицине - слепки, шины, в художественно- прикладном творчестве.
Na2SO4∙ 10H2O – глауберова соль, в медицине как слабительное, в производстве стекла
BaSO4 –в медицине, (рентген желудка), в производстве бумаги, резины как наполнитель
2) в цветной металлургии (гидрометаллургия, получение меди, никеля и т.д.) и обработке металлов (печатные платы, гальваника, аккумуляторы и т.д.)
3) неорганический синтез (производство минеральных удобрений, пигментов, кислот…) и органический синтез (производство красителей, ВВ, полимеров…)
4) производство бумаги
5) производство соды (стекло, СМС)
Соли серной кислоты не обладают окислительными свойствами, вступают в обычные реакции ионного обмена.
|
|
|


