 |
Парфюмерно-косметическая продукция (ПКП)
|
|
|
|
Основным документом, определяющим требования к парфюмерно-косметической продукции, является Технический регламент, утвержденный Комиссией Таможенного Союза в соответствии с которым Свидетельство о государственной регистрации должны иметь:
1. Парфюмерно-косметическая продукция для искусственного загара
2. Парфюмерно-косметическая продукция для отбеливания (осветления) кожи
3. Косметика для татуажа
4. Интимная косметика
5. Парфюмерно-косметическая продукция индивидуальной защиты кожи от воздействия вредных производственных факторов
6. Детская косметика
7. Парфюмерно-косметическая продукция для химического окрашивания, осветления и мелирования волос
8. Парфюмерно-косметическая продукция для химической завивки и распрямления волос
9. Парфюмерно-косметическая продукция, произведенная с использованием наноматериалов
10. Парфюмерно-косметическая продукция для депиляции
11. Пилинги
12. Фторсодержащие средства гигиены полости рта, массовая доля фторидов в
которых превышает 0,15% (для жидких средств гигиены полости рта – 0,05%)
13. Средства для отбеливания зубов, содержащие перекись водорода или другие компоненты, выделяющие перекись водорода, включая перекись карбамида и перекись цинка, с концентрацией перекиси водорода (в качестве ингредиента или выделяемой) 0,1% - 6,0% перекись водорода, включая перекись карбамида и перекись цинка.
На остальную продукцию поставщик должен предоставлять сведения о Декларации о соответствии ПКП требованиям технического регламента. Свидетельство о государственной регистрации также как и Декларация о соответствии являются товаросопроводительными документами.
Свидетельство о регистрации и Декларация о соответствии могут быть оформлены на одно или несколько названий одного наименования ПКП и действуют до внесения изменений в название или рецептуру ПКП.
|
|
|
При приемке парфюмерно-косметические товары распаковываются и осматриваются, проверяется качество (по внешним признакам) каждой единицы товара и наличие о нем необходимой информации.
Требования по маркировке потребительской тары приведены в ТР ТС 009/2011 и предусматривают обязательное наличие:
- наименование, название ПКП
- назначение
- соответствующая маркировка, если ПКП предназначена для детей
- наименование производителя и его местонахождения (юр.адрес, страна)
- страна происхождения (если отличается от места нахождения производителя)
- наименование организации, уполномоченной производителем на принятие претензий от потребителей
- номинальное количество в упаковке
- цвет или тон (для окрашивающих средств и декоративной косметики
- массовую долю фторида для средств гигиены полости рта
- срок годности, дата изготовления
- описание особых условий хранения (если требуется)
- особые меры предосторожности (если требуется)
- № партии или код, идентифицирующий ПКП
- список ингредиентов.
Единый знак обращения наносится на каждую единицу продукции, упаковку ИЛИ сопроводительную документацию.
Предметы и средства по уходу за новорожденными и детьми до 3-х лет:
К предметам и средствам по уходу за новорожденными и детьми до 3-х лет относятся:
- Средства защиты ребенка "от современного быта"
- Рюкзак "кенгуру"
- Детское автомобильное сидение
- Варежки для самых маленьких (без пальчиков) ''антицарапательные''
- Термометр для измерения температуры тела (в т.ч. электронный)
- Полихлорвиниловая пленка или специальные детские клеенки
- Подгузники, трусы, пеленки разового использования
- Спринцовки
|
|
|
- Аспиратор
- Детское мыло
- Детский крем
- Детское масло
- Защитный детский крем, детское косметическое молочко
- Детский шампунь
- Детская пена для ванн
- Влажные салфетки
- Гигиенические салфетки, пропитанные маслом
- Присыпка
- Детская ванночка и стул для ванны (когда ребенок начнет сидеть)
- Термометр для измерения температуры воды.
- Термометр для измерения температуры воздуха
- Прорезыватели для зубов в виде погремушек, колец
- Ватные палочки (с ограничителями)
- Расческа щеточка для волос (для самых маленьких детей)
- Ножницы с тупыми концами
- Соски-пустышки, соски молочные
- Посуда, столовые приборы для детей до 3-х лет (поильники, ложки, вилки, миски и т.п. для пищевых продуктов)
- И другие предметы при условии наличия соответствующего указания в сертификате/декларации производителя данной продукции.
В соответствии с Техническим регламентом, утвержденным комиссией Таможенного союза, государственная регистрация с выдачей Свидетельства о государственной регистрации продукции производится для следующих наименований:
- соски молочные, соски-пустышки из латекса, резины или силиконовые;
- изделия санитарно-гигиенические разового использования (подгузники, трусы, пеленки, гигиенические ватные палочки (для носа и ушей);
- посуда, столовые приборы для детей до 3-х лет (чашки, блюдца, поильники, тарелки, миски, ложки, вилки, бутылочки и другие аналогичные изделия для пищевых продуктов);
- щетки зубные, щетки зубные электрические с питанием от химических источников тока, массажеры для десен и другие аналогичные изделия для детей до 3-х лет;
- изделия 1-го слоя бельевые трикотажные и из текстильных материалов для детей до 3-х лет;
- изделия чулочно-носочные трикотажные 1-го слоя для детей до 3-х лет;18 ТР ТС 007/2011
- головные уборы (летние) 1-го слоя трикотажные и из текстильных материалов для детей до 3-х лет.
Подтверждающим документом соответствия продукции, подлежащей государственной регистрации является Декларация о соответствии.
Подтверждение соответствия продукции может осуществляется предоставлением Сертификата, выданным аккредитованным органом по сертификации с участием аккредитованной испытательной лаборатории (центра).
|
|
|
По желанию заявителя декларирование соответствия продукции может быть заменено сертификацией.
Обязательной сертификации подлежит следующая продукция:
- изделия санитарно-гигиенические из резины формовые и неформовые для ухода за детьми;
- изделия санитарно-гигиенические и галантерейные из пластмасс и металла;
- белье детское постельное;
- изделия 1-го слоя бельевые трикотажные и из текстильных материалов
При приемке товара необходимо обратить внимание на соответствие маркировки детской продукции требованиям ст. 9 Технического регламента:
1. Маркировка продукции должна быть достоверной, проверяемой, читаемой и доступной для осмотра и идентификации. Маркировку продукции наносят на изделие, этикетку, прикрепляемую к изделию или товарный ярлык, упаковку изделия, упаковку группы изделий или листок-вкладыш к продукции.
2. Маркировка продукции должна содержать следующую информацию:
- наименование страны, где изготовлена продукция;
- наименование и местонахождение изготовителя (уполномоченного изготовителем лица),
- импортера, дистрибьютора;
- наименование и вид (назначение) изделия;
- дата изготовления;
- единый знак обращения на рынке;
- срок службы продукции (при необходимости);
- гарантийный срок службы (при необходимости);
- товарный знак (при наличии).
3. Информация должна быть представлена на русском языке или государственном языке государства-члена Таможенного союза, на территории которого данное изделие производится и реализуется потребителю.
Для импортной продукции допускается наименование страны, где изготовлена продукция, наименование изготовителя и его юридический адрес указывать с использованием латинского алфавита.
4. Не допускается использования указаний "экологически чистая", "ортопедическая" и других аналогичных указаний без соответствующего подтверждения.
5. Маркировка сосок молочных и сосок-пустышек должна наноситься на закрытую упаковку и содержать гарантийный срок службы, инструкцию по использованию, хранению, гигиеническому уходу за изделием.
|
|
|
6. Изделия санитарно-гигиенические разового использования для ухода за детьми должны иметь инструкцию, содержащую информацию с указанием назначения, размера, рекомендаций по правильному выбору вида и размера изделия, способов ухода за изделием и его утилизации (при необходимости).
7. Маркировка посуды и изделий санитарно-гигиенических и галантерейных должна содержать обозначение материала, из которого изготовлено изделие, и инструкцию по эксплуатации и уходу.
Изделия, по форме и виду аналогичные применяемым изделиям для пищевых продуктов, но не предназначенные для контакта с пищевыми продуктами, должны иметь маркировку «Для не пищевых продуктов» или указание их конкретного назначения.
Изделия для новорожденных и бельевые изделия для детей до 1 года необходимо сопровождать информацией "Предварительная стирка обязательна".
Издательская (учебная, книжная и журнальная) продукция для детей также подпадает под регулирование Технического регламента Таможенного союза «О безопасности продукции, предназначенной для детей и подростков».
Медицинские изделия:
Медицинские изделия должны быть зарегистрированы, включены в Реестр медицинских изделий и иметь Сертификат или Декларацию, подтверждающую соответствие качества.
Маркировка медицинских изделий должна содержать следующие данные на русском языке:
- наименование медицинского изделия;
- обозначение модели (типа, вида, артикула) и (или) исполнения медицинского изделия, комплектация (при необходимости);
- наименование страны-производителя (изготовителя);
- наименование, товарный знак (при наличии), местонахождение (юридический адрес) производителя (изготовителя), адрес места производства (изготовления);
- номер и дата регистрационного удостоверения на медицинское изделие;
- основные свойства и характеристики медицинского изделия, указанные в метрической системе мер (Международной системе единиц);
- штриховой код (при наличии);
- срок годности медицинского изделия (месяц, год) или срок службы, установленный производителем (изготовителем);
- дата производства (изготовления) медицинского изделия;
- особые условия хранения и (или) применения (эксплуатации);
- указание о стерильности с указанием метода стерилизации (для стерильных медицинских изделий);
- номер серии (партии);
- указание о том, что медицинское изделие предназначено для однократного
- особые инструкции производителя (изготовителя) (предупреждения и меры предосторожности, которые необходимо исполнять, манипуляционные надписи) (при необходимости);
|
|
|
- единый знак обращения продукции на рынке государств - членов Таможенного союза.
Сведения о номере регистрационного удостоверения и дате государственной регистрации изделия медицинского назначения должны быть доступны для потребителя (нанесены на упаковку, этикетку, инструкцию по применению, эксплуатационную документацию), а также содержаться на рекламной продукции, предназначенной для конечного потребителя.
Минеральные воды: В соответствии с Едиными санитарными требованиями Таможенного союза к минеральным водам относятся природные и искусственные минеральные воды с уровнем минерализации не менее 1 г/л.
Вода минеральная должна быть разлита в потребительскую тару, предназначенную для контакта с пищевыми продуктами. Маркировка минеральной воды должна содержать информацию в соответствии с требованиями действующих технических и нормативных правовых актов.
Условия хранения, а также срок годности должны соответствовать требованиям, указанным в нормативной документации изготовителя на готовую продукцию, утвержденную в установленном порядке.
Маркировка минеральных вод и столовых вод должна содержать следующую информацию:
1) обозначение вида продукции как минеральной воды или как столовой воды
2) тип (газированная, негазированная);
3) номер скважины (скважин) и/или наименование месторождения (название участка месторождения) или наименование источника
4) наименование и местонахождение изготовителя;
5) наименование и местонахождение организации, уполномоченной на принятие претензий на территории Российской Федерации (для импортной продукции);
6) общая минерализация или сухой остаток (грамм/литр);
7) химический состав минеральной воды и столовой воды, характеризующий и позволяющий идентифицировать данную минеральную воду (определяет изготовитель) в пределах естественных вариаций.
8) Наименование природной минеральной воды должно соответствовать географическому, историческому месту ее происхождения (для минеральных вод под географическим объектом понимается месторождение или его участок), либо быть фантазийным.
9) В маркировке минеральных вод запрещается упоминать любые особые свойства, в том числе связанные с происхождением природной минеральной воды (название месторождения), включая название минеральной воды, если отсутствуют доказательства, подтверждающие декларируемые свойства.
6.3. Процесс «Хранение товара»
Принцип:
Организация должна сохранять продукцию в ходе внутренней обработки и в процессе поставки к месту назначения в целях поддержания ее соответствия установленным требованиям.
Лекарственные препараты хранятся в условиях, указанных производителем на упаковке.
Правила хранения лекарственных средств установлены Государственной фармакопеей.
В аптечных организациях допускается хранение фармацевтических субстанций, обладающих легковоспламеняющимися и горючими свойствами, в объеме до 10 кг во встроенных несгораемых шкафах. Шкафы должны быть удалены от тепловыделяющих поверхностей и проходов. К ним должен быть организован свободный доступ.
Допускается хранение взрывоопасных лекарственных препаратов для медицинского применения (во вторичной (потребительской) упаковке) для использования на одну рабочую смену в металлических шкафах вне помещений для хранения огнеопасных фармацевтических субстанций и взрывоопасных лекарственных препаратов.
Медицинские изделия должны храниться отдельно по группам, в соответствии с установленными требованиями.
6.4. Процесс «Реализация товара»
Принцип:
Реализация товара в аптечных организациях включает в себя продажу и отпуск лекарственных препаратов и иных товаров аптечного ассортимента, оказание консультационных услуг в пределах компетенций фармацевтических работников. Основополагающим принципом является забота о здоровье и благополучии потребителей.
Реализация лекарственных препаратов должна осуществляться фармацевтическими работниками.
В торговом зале в удобном для обозрения месте должна быть размещена следующая информация для потребителей:
- копия лицензии на фармацевтическую деятельность;
- информация о невозможности возврата и обмена товаров аптечного ассортимента надлежащего качества (перечень непродовольственных товаров надлежащего качества, не подлежащих возврату или обмену на аналогичный товар других размера, формы, габарита, фасона, расцветки или комплектации, утвержденный в порядке, установленном законодательством);
- информация о невозможности возврата и замены БАД, лечебного и детского питания надлежащего качества;
- иная информация, которая должна быть доведена до сведения потребителей в соответствии с требованиями действующего законодательства.
По требованию потребителя фармацевтический работник обязан ознакомить его с товарно-сопроводительной документацией на товар, содержащей по каждому наименованию товара сведения об обязательном подтверждении соответствия согласно законодательству Российской Федерации о техническом регулировании (сертификат соответствия, его номер, срок его действия, орган, выдавший сертификат, или сведения о декларации о соответствии, в том числе ее регистрационный номер, срок ее действия, наименование лица, принявшего декларацию, и орган, ее зарегистрировавший). Эти документы должны быть заверены подписью и печатью поставщика или продавца с указанием его места нахождения (адреса) и телефона.
Аптечные организации, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, наряду с лекарственными препаратами имеют право приобретать и продавать товары аптечного ассортимента (нелекарственные товары), их продажу могут осуществлять специалисты, не имеющие фармацевтического образования.
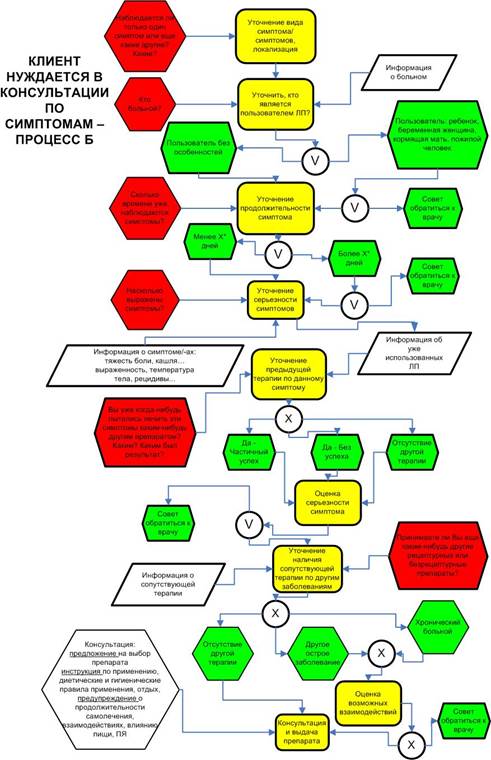
Фармацевтические работники аптечной организации должны уделять особое внимание консультациям по вопросам ответственного самолечения. Для каждого симптома недомогания, которое можно лечить самостоятельно, в аптеке должна существовать процедура опроса, которой следует фармацевтический работник. Минимальная схема опроса потребителя представлена в Приложениях: «КЛИЕНТ СПРАШИВАЕТ ПРЕПАРАТ – ПРОЦЕСС A» (Приложение № 1 к настоящим Правилам), «КЛИЕНТ НУЖДАЕТСЯ В КОНСУЛЬТАЦИИ ПО СИМПТОМАМ ПРОЦЕСС Б» (Приложение 2 к настоящим Правилам).
Если пациент принял решение о покупке лекарственного препарата, медицинского изделия или БАД, фармацевтический работник должен приложить все усилия, чтобы у больного или ухаживающего за ним человека было достаточное представление относительно:
- действия препарата
- способа его применения: как, когда, в каких дозах
- продолжительности лечения препаратом
- возможных побочных эффектах
- противопоказаниях к применению
- сочетаемости с другими препаратами и пищей
- цены препарата и его синонимов, а также стоимости курса лечения
- невозможности возврата и обмена лекарственных препаратов надлежащего качества
- невозможности возврата и обмена товаров (БАД и медицинских изделий)
- правил хранения препарата в домашних условиях
- о необходимости обращения к врачу, если симптомы не исчезнут через определенный период и опасности самовольной отмены препарата.
- обратной связи с потребителями, включая жалобы потребителей.
В каждой аптечной организации должна находиться книга отзывов и предложений, которая предоставляется покупателю по его требованию.
Кроме этого можно предусмотреть и другие способы общения с потребителями: анкетирование на выходе, ящик для пожеланий и рекомендаций администрации аптечной организации, опрос фармацевтических работников, занятых обслуживанием потребителей, на предмет пожеланий посетителей аптеки и т.п.
Для предоставления услуг по консультированию и иных фармацевтических услуг целесообразно выделить зону для индивидуальной беседы. Зона может быть выделена любым способом, установленным руководителем организации нанесением яркой границы для ожидания потребителей, установкой специальных ограничителей, организацией сидячих мест и т.п.
Аптечная организация самостоятельно определяет ассортиментную матрицу продукции, соблюдая требования в отношении обязательного наличия минимального ассортимента ЛП.
Ассортимент прочих товаров определяет руководитель аптечной организации, руководствуясь наличием достаточных площадей для ознакомления Потребителей с имеющимся в продаже товаром.
7. Проведение оценки деятельности
Принцип:
Оценка деятельности аптечной организации проводится с целью проверки полноты выполнения требований настоящих Правил и определения необходимых корректирующих действий самой организацией.
Вопросы, касающиеся персонала, помещений, оборудования, документации, соблюдения правил реализации лекарственных средств, мероприятий по работе с отзывами и предложениями потребителей, работа по выявлению несоответствующей продукции, а также деятельности по проведению внутренних аудитов, должны регулярно анализироваться в соответствии с заранее утвержденной программой по определенному графику для проверки их соответствия принципам системы управления качеством организации.
Внутренние аудиты должны проводиться независимо и тщательно специально назначенными лицами, состоящими в штате аптечной организации или на договорной основе. При необходимости может быть проведен независимый аудит экспертами сторонних аптечных организаций либо членами профессионального сообщества.
Результаты внутренних аудитов должны быть оформлены документально. Отчеты, составленные по результатам аудитов, должны включать в себя всю полученную информацию и предложения по необходимым корректирующим действиям (где применимо). Действия, предпринимаемые по результатам проведенных внутренних аудитов, также следует оформлять документально.
7.1. Удовлетворенность потребителей
Организация вправе проводить мониторинг информации, касающийся восприятия потребителем выполнения организацией его требований, как одного из способов измерения эффективности системы менеджмента качества. С этой целью организации следует разработать методы получения и использования этой информации.
7.2. Внутренние аудиты (проверки)
Организация должна проводить внутренние аудиты (проверки, самоинспекции) через запланированные интервалы времени в подтверждения, что обязательные требования выполняются всеми подразделениями/сотрудниками аптечной организации.
Внутренние проверки проводятся с целью выявления недостатков по выполнению требований действующего законодательства и нормативно-правовых актов по фармацевтической деятельности и вынесения рекомендаций по корректирующим и предупреждающим действиям.
Программа аудитов (проверок) должна планироваться с учетом статуса и важности процессов и участков, подлежащих аудиту, а также результатов предыдущих аудитов, включая акты проверок контролирующих органов.
Записи об аудитах и их результатах должны поддерживаться в рабочем состоянии.
Руководство, ответственное за проверяемые области деятельности, должно обеспечить, чтобы все необходимые коррекции и корректирующие действия предпринимались незамедлительно. Последующие действия должны включать в себя проверку предпринятых мер и отчет о результатах выполненных действий и их эффективности.
7.3. Управление несоответствующей продукцией
Организация должна обеспечивать идентификацию продукции, не соответствующей требованиям, и управление ею в целях предотвращения непреднамеренного использования или поставки такой продукции.
Несоответствующая продукция должны быть своевременно идентифицирована и изолирована от остального товара в порядке и сроки, установленные действующим законодательством. Маркировка, место и способы выделения карантинной зоны устанавливаются приказом руководителя организации. Кроме этого приказом руководителя должно быть определено ответственное лицо за работу с несоответствующей продукцией.
8. Постоянное улучшение
Организация должна постоянно повышать результативность системы менеджмента качества посредством использования политики и целей в области качества, результатов аудитов, анализа данных, корректирующих и предупреждающих действий, а также анализа со стороны руководства.
8.1. Корректирующие действия
Организация должна предпринимать корректирующие действия в целях устранения причин несоответствий для предупреждения повторного их возникновения. Корректирующие действия должны быть адекватными последствиям выявленных несоответствий.
Организация должна определить требований:
- К анализу несоответствий (включая жалобы потребителей);
- К установлению причин несоответствий (нарушение условий приемки товара и хранения);
- К оцениванию необходимости действий, чтобы избежать повторения несоответствий;
- К определению и осуществлению необходимых действий (недопущение попадания несоответствующей продукции потребителю);
- К записям результатов предпринятых действий;
- К анализу результативности предпринятых корректирующих действий.
8.2. Предупреждающие действия
Организация должна определять действия в целях устранения причин потенциальных несоответствий для предупреждения их появления. Предупреждающие действия должны соответствовать возможным последствиям потенциальных проблем.
Должна быть разработана документированная процедура для определения требований:
- к установлению потенциальных несоответствий и их причин;
- к оцениванию необходимости действий в целях предупреждения появления несоответствий (дополнительное обучение сотрудников, закупка дополнительного оборудования и т.п.);
- к определению и осуществлению необходимых действий;
к записям результатов предпринятых действий;
к анализу результативности предпринятых предупреждающих действий.
Приложение № 1.
«КЛИЕНТ СПРАШИВАЕТ ПРЕПАРАТ – ПРОЦЕСС A»

Приложение № 2.
«КЛИЕНТ НУЖДАЕТСЯ В КОНСУЛЬТАЦИИ ПО СИМПТОМАМ ПРОЦЕСС Б»
|
|
|


