 |
Парасимпатическая нервная система
|
|
|
|
Возбуждение парасимпатических нервов (n. vagi) сопровождается высвобождением медиатора ацетилхолина (АX), который взаимодействует с М-холинорецепторами клеток-мишеней, вызывая урежение сердечных сокращений (отрицательный хронотропный эффект), замедление проводимости по атриовентрикулярному узлу вплоть до полной блокады проведения (отрицательный дромотропный эффект), уменьшение силы и скорости сокращения (отрицательный инотропный эффект). Ацетилхолин, освобождаемый из нервных окончаний парасимпатических волокон способен стимулировать М-холинорецепторы, расположенные на окончаниях симпатических волокон, что приводит к угнетению освобождения из них норадреналина. В табл. 2 представлены основные эффекты стимуляции М-холинорецепторов.
Таблица 2. Важнейшие эффекты стимуляции М-холинорецепторов
| Локализация | Эффекты | Механизмы |
| СА-узел | Отрицательный хронотропный | Уменьшение автоматизма Гиперполяризация клеточных мембран Снижение скорости диастолической деполяризации |
| АВ-узел | Отрицательный дромотропный | Замедление проводимости (увеличение А-Н-интервала) Увеличение рефрактерного периода |
| Миокард предсердий | Отрицательный инотропный | Укорочение длительности ТМПД Гиперполяризация мембран Укорочение рефрактерного периода |
| Волокна Пуркинье | Отрицательный дромотропный | Замедление проведения Повышение автоматизма |
| Миокард желудочков | Отрицательный инотропный | Дисперсия реполяризации желудочков Удлинение рефрактерного периода |
| Артериолы | Релаксация | Неизвестен (возможно, стимуляция эндотелиальных факторов расслабления) |
N.B.!
1. Стимуляция b1-адренорецепторов сопровождается увеличением сократимости миокарда предсердий и желудочков, ЧСС, скорости расслабления миокарда, ускорением проведения электрического импульса в АВ-узле, увеличением возбудимости сердечной мышцы.
|
|
|
2. Возбуждение a1-адренорецепторов также сопровождается положительным инотропным эффектом и, кроме того, при длительной активации симпатической нервной системы способствует постепенному формированию гипертрофии сердечной мышцы.
3. Стимуляция М-холинорецепторов (парасимпатическая нервная система) вызывает урежение сердечных сокращений, замедление проводимости по АВ-узлу, уменьшение силы и скорости сокращения сердечной мышцы.
Cимпатические и парасимпатические влияния на сердце регулируются сердечными центрами продолговатого мозга и моста, корой головного мозга и гипоталамусом. Все системы регуляции работы сердца приводят к изменению кардиодинамики, адекватным потребностям организма.
Наиболее наглядно работа сердца описывается петлей «давление – объем» (рис.2).
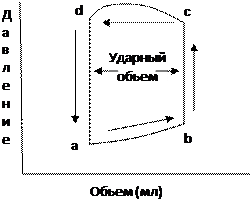 |
Рис. 2. Пример петли «давление — объем» левого желудочка (ЛЖ) в норме. В точке «а » открывается митральный клапан. Во время диастолического заполнения ЛЖ (линия «ab») объем возрастает, что ассоциируется с постепенным ростом давления. Когда начинается сокращение ЛЖ, и давление в нем превышает давление в левом предсердии, митральный клапан (МК) закрывается, и происходит изоволюметрическое сокращение ЛЖ (аортальный клапан еще не открыт, и кровь не покидает полость ЛЖ), представленное линией «bс». Когда давление в ЛЖ возрастает до уровня давления в аорте, открывается аортальный клапан (АК) — точка «с» — и начинается изгнание крови. Во время изгнания объем внутри ЛЖ уменьшается (линия «cd»), но давление в нем продолжает нарастать, пока не наступит диастола. Снижающееся во время диастолы давление в ЛЖ в точке «d» становится меньше уровня давления в аорте, и АК закрывается, после чего начинается изоволюметрическое расслабление (линия «da»). При дальнейшем снижении давления в ЛЖ вновь открывается митральный клапан (точка «а»). Точка «b» отражает конечный диастолический объем и давление, а точка «d» — конечный систолический объем и давление. Ударный объем представляет собой разность между КДО и КСО.
|
|
|
При нарушениях гомеостаза организма, связанного с кровоснабжением, будут задействованы вышеперечисленные механизмы, но при их длительном функционировании развиваются и другие приспособительные реакции. К ним будут относиться: развитие гипертрофии миокарда; активация систем - ренин-ангиотензин-альдостероновой системы (РААС), системы аргинин-вазопрессин (антидиуретический гормон), предсердного натрийуретического пептида (ПНУП); гиперактивация САС; изменение функции эндотелия.
Гипертрофия миокарда развивается при длительной активации САС, увеличении уровня РААС (как общей, так и тканевой), повышение содержания эндотелина-1. Увеличение толщины миокарда способствует уменьшению внутримиокардиального напряжения, позволяя желудочку развивать достаточное внутрижелудочковое давление в систолу. Со временем при гипертрофии сердечной мышцы происходит изнашивание сократительного миокарда: истощаются процессы белкового синтеза и энергетического обеспечения кардиомиоцитов, нарушается соотношение между сократительными элементами и капиллярной сетью, повышается концентрация внутриклеточного Са2+, развивается фиброз сердечной мышцы и т.п. Одновременно происходит снижение диастолической податливости камер сердца и развивается диастолическая дисфункция гипертрофированного миокарда. Кроме того, наблюдаются выраженные нарушения метаболизма миокарда:
• уменьшается АТФ-азная активность миозина, обеспечивающего сократимость миофибрилл за счет гидролиза АТФ;
• нарушается сопряжение возбуждения с сокращением;
• нарушается образование энергии в процессе окислительного фосфорилирования и истощаются запасы АТФ и КФ.
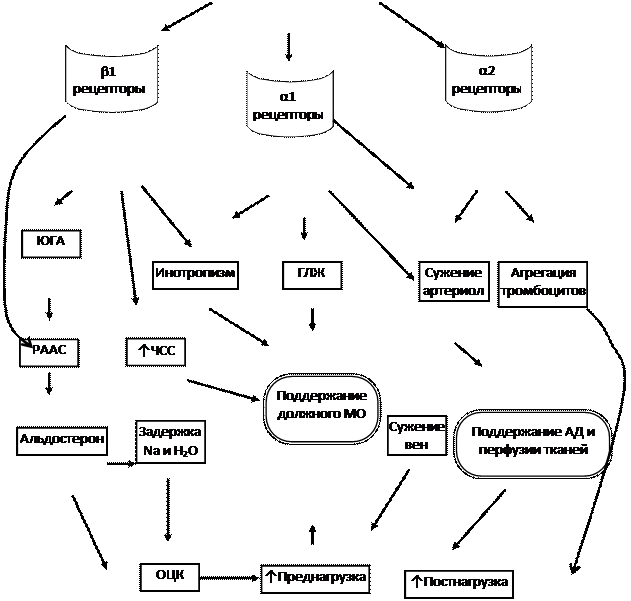
Гиперактивация симпатико-адреналовой системы и повышение концентрации катехоламинов (А и На) является одним из наиболее ранних компенсаторных факторов при возникновении сердечной недостаточности. При снижении систолической функции миокарда левого желудочка происходит снижение сердечного выброса. В результате уменьшается напряжение стенок аорты и каротидного синуса, поэтому снижается активность соответствующих барорецепторов. Под влиянием этих барорецепторов тормозится симпатическая и активируется парасимпатическая нервная система. Поэтому при снижении активности барорецепторов уменьшается торможение симпатической и увеличивается торможение парасимпатической нервной системы. В результате увеличивается ЧСС, тонус периферических артерий (ОПСС) и вен (увеличивается возврат крови к сердцу), сократимость миокарда, стимулируется гипертрофия миокарда, подавляется активность метасимпатической нервной системы, стимулируются бета – адренорецепторы юкстагломерулярных клеток за счет чего активируется РААС, возникает дисфункция эндотелия, что приводит к активации тканевых РАС.
|
|
|
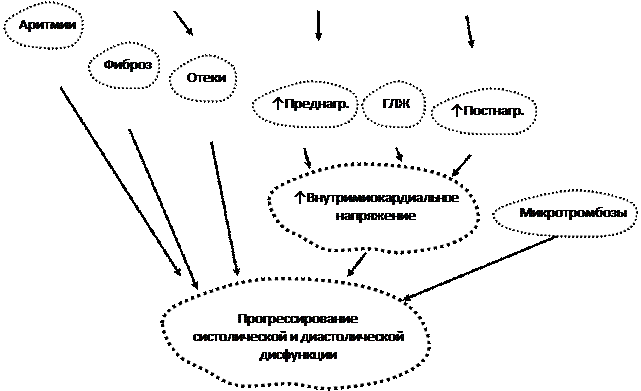
Таким образом, на начальных этапах развития заболевания повышение активности САС способствует увеличению сократимости миокарда, притока крови к сердцу, величины преднагрузки и давления наполнения желудочков, что в конечном итоге приводит к сохранению в течение определенного времени достаточного сердечного выброса. Однако длительная гиперактивация САС у больных хронической СН может иметь многочисленные негативные последствия, способствуя:
1. Значительному увеличению преднагрузки и постнагрузки (за счет чрезмерной вазоконстрикции, активации РААС и задержки натрия и воды в организме).
2. Повышению потребности миокарда в кислороде (в результате положительного инотропного эффекта активации САС).
3. Уменьшению плотности b-адренергических рецепторов на кардиомиоцитах, что со временем приводит к ослаблению инотропного эффекта катехоламинов (высокая концентрация катехоламинов в крови уже не сопровождается адекватным увеличением сократимости миокарда).
4. Прямому кардиотоксическому эффекту катехоламинов (некоронарогенные некрозы, дистрофические изменения миокарда).
|
|
|
5. Развитию фатальных желудочковых нарушений ритма (желудочковой тахикардии и фибрилляции желудочков) и т.д
Рис. 3. Эффекты активации САС.
 | |||
 |
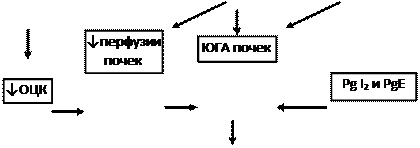
Гиперактивация РААС играет особую роль в формировании СН. При этом имеет значение не только почечно-надпочечниковая РААС с циркулирующими в крови нейрогормонами (ренином, ангиотензином-II, ангиотензином-III и альдостероном), но и локальные тканевые (в том числе миокардиальная) ренин-ангиотензиновые системы. Активация почечной ренин-ангиотензиновой системы, наступающая при любом самом незначительном снижении перфузионного давления в почках, сопровождается выделением клетками ЮГА почек ренина, расщепляющего ангиотензиноген с образованием пептида — ангиотензина I (АI). Последний под действием ангиотензин-превращающего фермента (АПФ) трансформируется в ангиотензин II, который является основным и наиболее мощным эффектором РААС. Характерно, что ключевой фермент этой реакции — АПФ — локализуется на мембранах эндотелиальных клеток сосудов легких, проксимальных канальцев почек, в миокарде, плазме, где и происходит образование АII. Его действие опосредуется специфическими ангиотензиновыми рецепторами (АТ1 и АТ2), которые находятся в почках, сердце, артериях, надпочечниках и т.д. Важно, что при активации тканевых РАС имеются и другие пути (помимо АПФ) превращения АI в АII: под действием химазы, химазоподобного фермента (CAGE), катепсина G, тканевого активатора плазминогена (ТАП) и др. Наконец, воздействие АII на АТ2-рецепторы клубочковой зоны коркового вещества надпочечников приводит к образованию альдостерона, основным эффектом которого является задержка в организме натрия и воды, что способствует увеличению ОЦК.
В целом активация РААС сопровождается следующими эффектами:
• выраженной вазоконстрикцией, повышением АД;
• задержкой в организме натрия и воды и увеличением ОЦК;
• повышением сократимости миокарда (положительное инотропное действие);
• инициированием развития гипертрофии и ремоделирования сердца;
• активацией образования соединительной ткани (коллагена) в миокарде;
• повышением чувствительности миокарда к токсическому влиянию катехоламинов.
Активация РААС при острой СН и на начальных этапах развития хронической СН имеет компенсаторное значение и направлена на поддержание нормального уровня АД, ОЦК, перфузионного давления в почках, увеличение пред- и постнагрузки, увеличение сократимости миокарда. Однако в результате длительной гиперактивации РААС развивается ряд отрицательных эффектов:
|
|
|
1. увеличение ОПСС и снижение перфузии органов и тканей;
2. чрезмерное увеличение постнагрузки на сердце;
3. значительная задержка жидкости в организме, что способствует формированию отечного синдрома и повышению преднагрузки;
4. инициация процессов ремоделирования сердца и сосудов, в том числе гипертрофии миокарда и гиперплазии гладкомышечных клеток;
5. стимуляция синтеза коллагена и развитие фиброза сердечной мышцы;
6. развитие некроза кардиомиоцитов и прогрессирующее повреждение миокарда с формированием миогенной дилатации желудочков;
7. повышение чувствительности сердечной мышцы к катехоламинам, что сопровождается возрастанием риска возникновения фатальных желудочковых аритмий у больных СН.
|
|
| ||||||||
 | ||||||||||
 | ||||||||||
 |

 | |||||||
 | |||||||
|
|
Рис. 4. Эффекты активации РААС.
Антидиуретический гормон (АДГ), секретируемый задней долей гипофиза, участвует в регуляции проницаемости для воды дистальных отделов канальцев почек и собирательных трубок. Например, при недостатке в организме воды и дегидратации тканей происходит уменьшение объема циркулирующей крови (ОЦК) и увеличение осмотического давления крови (ОДК). В результате раздражения осмо- и волюморецепторов усиливается секреция АДГ задней долей гипофиза. Под влиянием АДГ повышается проницаемость для воды дистальных отделов канальцев и собирательных трубок, и, соответственно, усиливается факультативная реабсорбция воды в этих отделах. В итоге выделяется мало мочи с высоким содержанием осмотически активных веществ и высокой удельной плотностью мочи.
Наоборот, при избытке воды в организме и гипергидратации тканей в результате увеличения ОЦК и уменьшения ОДК происходит раздражение осмо- и волюморецепторов, и секреция АДГ резко снижается или даже прекращается. В результате реабсорбция воды в дистальных отделах канальцев и собирательных трубках снижается, тогда как Na+ продолжает реабсорбироваться в этих отделах. Поэтому выделяется много мочи с низкой концентрацией осмотически активных веществ и низкой удельной плотностью. Нарушение функционирования этого механизма при сердечной недостаточности может способствовать задержке воды в организме и формированию отечного синдрома. Чем меньше сердечный выброс, тем больше раздражение осмо- и волюморецепторов, что приводит к увеличению секреции АДГ и, соответственно, задержке жидкости.
Предсердный натрийуретический пептид (ПНУП) является своеобразным антагонистом вазоконстрикторных систем организма (САС, РААС, АДГ и других). Он продуцируется миоцитами предсердий и выделяется в кровоток при их растяжении. ПНУП вызывает вазодилатирующий, натрийуретический и диуретический эффекты, угнетает секрецию ренина и альдостерона. Секреция ПНУП — это один из наиболее ранних компенсаторных механизмов, препятствующих чрезмерной вазоконстрикции, задержке Nа+ и воды в организме, а также увеличению пред- и постнагрузки.
Активность ПНУП быстро усиливается по мере прогрессирования СН. Однако, несмотря на высокий уровень циркулирующего ПНУП, степень его положительных эффектов при хронической СН заметно снижается, что связано, вероятно, с уменьшением чувствительности рецепторов и увеличением расщепления пептида. Поэтому максимальный уровень циркулирующего ПНУП ассоциируется с неблагоприятным течением хронической СН.
Нарушениям эндотелиальной функции в последние годы придается особое значение в формировании и прогрессировании ХСН. Дисфункция эндотелия, возникающая под действием различных повреждающих факторов (гипоксии, чрезмерной концентрации катехоламинов, ангиотензина II, серотонина, высокого уровня АД, ускорения кровотока и т.д.), характеризуется преобладанием вазоконстрикторных эндотелийзависимых влияний и закономерно сопровождается повышением тонуса сосудистой стенки, ускорением агрегации тромбоцитов и процессов пристеночного тромбообразования. К числу важнейших эндотелийзависимых вазоконстрикторных субстанций, повышающих сосудистый тонус, агрегацию тромбоцитов и свертываемость крови, относятся эндотелин-1 (ЭТ1), тромбоксан А2, простагландин PGH2, ангиотензин II (АII) и др. Они оказывают существенное влияние не только на сосудистый тонус, приводя к выраженной и стойкой вазоконстрикции, но и на сократимость миокарда, величину преднагрузки и постнагрузки, агрегацию тромбоцитов и т.д.. Важнейшим свойством эндотелина-1 является его способность ―запускать внутриклеточные механизмы, приводящие к усилению белкового синтеза и развитию гипертрофии сердечной мышцы. Последняя, как известно, является важнейшим фактором, так или иначе осложняющим течение СН. Кроме того, эндотелин-1 способствует образованию коллагена в сердечной мышце и развитию кардиофиброза. Существенную роль вазоконстрикторные субстанции играют в процессе пристеночного тромбообразования. Показано, что при тяжелой и прогностически неблагоприятной ХСН уровень эндотелина-1 повышен в 2–3 раза. Его концентрация в плазме крови коррелирует с выраженностью нарушений внутрисердечной гемодинамики, давлением в легочной артерии и уровнем летальности у пациентов с ХСН.
Сердечная недостаточность
Все возможные этиологические факторы по механизму развития сердечной недостаточности можно сгруппировать в три группы:
1) нарушающие сократимость,
2) повышающие постнагрузку,
3) нарушающие заполнение желудочка.
Сердечная недостаточность, которая развивается вследствие нарушения опорожнения желудочка (из-за снижения сократимости или повышения постнагрузки) называется систолической дисфункцией, а развивающаяся вследствие нарушения диастолического расслабления или заполнения желудочка называется диастолической дисфукнкцией.
Более чем в половине случаев (57%) у пациентов с явными клиническими признаками сердечной недостаточности показатели сократимости миокарда значимо не нарушены, т.е. развивается диастолическая сердечная недостаточность. Причем с возрастом количество пациентов с диастолической сердечной недостаточностью увеличивается, достигая 90% в старших возрастных группах. Диастолическая сердечная недостаточность может протекать изолированно, а систолическая – как правило, в сочетании с диастолической. Кроме того выделяют лево- и правожелудочковую недостаточность (в зависимости от преимущественного поражения отделов сердца).
В зависимости от преобладания тех или иных механизмов формирования СН выделяют следующие причины развития этого патологического синдрома:
|
|
|


