 |
Моль. Экспериментальное определение числа Авогадро (опыт Ж. Перрена).
|
|
|
|
Агрегатные состояния вещества
Твердое тело – сохраняет постоянный объем и форму.
Жидкости – практически не поддаются сжатию (постоянный объем), и принимают форму сосуда, в котором находятся.
Газы – не обладают ни определенной формой, ни определенным объемом: они полностью заполняют сосуды, в которых находятся.
Закон Дальтона о постоянстве состава
Закон Далтона о постоянстве состава: если два или более химических элементов образуют соединение, то они всегда входят в это соединение в одинаковых весовых пропорциях.
Закон постоянства состава свидетельствует об атомном строении вещества.
Этот закон позволяет определить относительные массы элементов. Единица массы установлена так, что атому углерода приписана масса 12 а.е.м. (атомных единиц массы).
Закон Паскаля. Закон Архимеда
Давление внутри жидкости в каждой точке одинаково по всем направлениям. Сила давления всегда перпендикулярна поверхности соприкосновения жидкости и стенки сосуда. Закон Паскаля: давление приложенное к жидкости или газу, находящимся в ограниченном объеме передается во все точки внутри объема без изменения.
P=F/S
Закон Архимеда: на тело погруженное в жидкость или газ действует выталкивающая сила, равная весу вытесненной телом жидкости или газа.
F=ρжgV
Моль. Экспериментальное определение числа Авогадро (опыт Ж. Перрена).
Количество вещества, в котором содержится число частиц (атомов, молекул, ионов, электронов и т. д.), равное числу атомов в 0,012 кг изотопа углерода 12С, называется молем. Употребляются также кратные и дольные единицы: киломоль (кмоль), мил-лимоль (ммоль), микромоль (мкмоль) и т. д.
Число частиц, содержащихся в моле вещества, называется числом Авогадро. Опытным путем найдено, что число Авогадро равно
|
|
|
NA = 6,022 *1023моль-1
Таким образом, например, в моле меди содержится NA атомов меди, в моле воды содержится NA молекул воды, в моле электронов содержится NA электронов и т. д.
Опыт Пррена:
Применив многократно метод центрифугирования, Перрену удалось приготовить весьма однородную эмульсию из практически одинаковых шариков гуммигута (сгущенный млечный сок, получаемый из надрезов в коре некоторых видев деревьев, растущих в Ост-Индии и на Цейлоне) с радиусами порядка нескольких десятых долей микрометра. Эмульсия помещалась в плоскую стеклянную кювету глубиной 0,1 мм и рассматривалась с помощью микроскопа.
Микроскоп имел столь малую глубину поля зрения, что в него были видны только частицы, находящиеся в горизонтальном слое толщиной примерно 1 мкм. Перемещая микроскоп в вертикальном направлении, можно было исследовать распределение броуновских частиц по высоте.
Написав выражение числа частиц ΔN для двух разных высот h1 и h2, получаем:
ΔN1=n0 exp(-p’h1/kT) SΔh ΔN2=n0 exp(-p’h2/kT) SΔh
Наконец, логарифмируя отношение ΔN1 / ΔN2 приходим к следующему выражению:
Ln(ΔN1 / ΔN2)= (-p’(h1-h2)/kT)
С помощью этой формулы по измеренным p’, Т, (h2 — hi), ΔN и можно определить постоянную Больцмана k. Далее, разделив газовую постоянную R на k, можно было найти число Авогадро NA.
Полученное Перреном на различных эмульсиях значение NA лежало в пределах от 6,5- 10?3 до 7,2- 1023 моль-1. Определенное другими, более точными методами значение NA равно 6,02- 1023 моль-1.
37Связь давл-я газа со средней кинет-ой энергией мол-л. Сред. квадратичная скорость молекул идеального газа
√V2 = √((V12+V22+..+VN2)/(N)) =
√∑(Vi2/N) = √(3RT/M) = √(3kT/m0)
k = 1,38*10-23 Дж/К – Больцмана
R = 8,31 Дж/мольК – универс-я газовая
m0 – масса мол-лы (атома)
М – молярная масса
Сред. кин. энергия поступат-го и вращат-го движения молекул идеал.о газа.
|
|
|
Ei = (ikT)/2;
i – число степеней свободы молекулы
i = 3 для 1-атомного газа
i = 5 для 2-атомного газа
i = 6 для многоатомного газа
Основное Ур-е молек.-кинет. теории идеального газа.
p = (nm0V2)/3 = (2/3)*nE
n – концентрация газа
38. Идеальный газ. Уравнение Клапейрона – Менделеева. Газовые законы для изопроцессов. Идеальный газ: У разреженного газа расстояние между молек-ми во много раз превышает их размеры. В этом случае взаимод-ие м/у мол-ми пренебрежимо мало и кин-я эн-я мол-л много больше пот-й эн-ии их взаимод-ия. Для объяснения св-в вещества в газообразном состоянии вместо реального газа используется его физ-я модель – идеал-й газ. В модели предполагается: 1)расстояние между молекулами чуть больше их диаметра; 2)молекулы – упругие шарики; 3)между молекулами не действуют силы притяжения; 4)при соударении молекул друг с другом и со стенками сосуда действуют силы отталкивают; 5)движения молекул подчиняется законам механики. Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Универсальная газовая постоянная: на основе зависимости давл-я газа от концент-ии его мол-л и темп-ы можно получить ур-е, связывающее все три макроскопических параметра: давление, объем и температуру – характеризующие состояние данной массы достаточно разреженного газа. Это ур-е называют уравнением состояния идеального газа.



 1. Изохорический процесс – объём газа остаётся постоянным, меняются p и T, нагревание газа в замкнутом объёме. Так как V=const, то ΔV=0 и ΔA=p*ΔV=0. При изохорич-ом процессе газ не сов-т работы: ΔQ=ΔU, – все сообщаемое газу тепло идёт на увеличение его внутр-й эн-ии. Молярная теплоёмк-ть: Сv = ΔQ/ΔT= ΔU/ΔT. 2. Изобарический процесс – процесс, проходящий при пост-ом давлении. Работа при изоб-ом расши-нии изобр-ся на графике площадью прямоугольника. ΔA=p*ΔV =p*(V2-V1). Подводимое к газу тепло частиыно тратится на увелич-е внутр-й эн-ии (на нагревание), а частично – на совершение работы. Молярная теплоёмк-ть: Сv = ΔQ/ ΔT= ΔU/ΔT+ΔA/ΔT. 3. Изотермический процесс. – процесс, проводимый при пост-й темп-ре газа. Из ур сост-я (Менделеева-Клапейрона): pV=const. На графике – гипербола. Так как внутр-я эн-я ид-го газа зависит только от его темп-ры, то при изотер-ом расширении U=const и ΔU=0. По первому зак-у термод-ки: ΔQ=ΔA. Подводимое к газу при изот-ом расши-нии тепло целиком превращ-ся в работу расширения. Теплоёмкость: СT = ΔQ/ΔT==∞.
1. Изохорический процесс – объём газа остаётся постоянным, меняются p и T, нагревание газа в замкнутом объёме. Так как V=const, то ΔV=0 и ΔA=p*ΔV=0. При изохорич-ом процессе газ не сов-т работы: ΔQ=ΔU, – все сообщаемое газу тепло идёт на увеличение его внутр-й эн-ии. Молярная теплоёмк-ть: Сv = ΔQ/ΔT= ΔU/ΔT. 2. Изобарический процесс – процесс, проходящий при пост-ом давлении. Работа при изоб-ом расши-нии изобр-ся на графике площадью прямоугольника. ΔA=p*ΔV =p*(V2-V1). Подводимое к газу тепло частиыно тратится на увелич-е внутр-й эн-ии (на нагревание), а частично – на совершение работы. Молярная теплоёмк-ть: Сv = ΔQ/ ΔT= ΔU/ΔT+ΔA/ΔT. 3. Изотермический процесс. – процесс, проводимый при пост-й темп-ре газа. Из ур сост-я (Менделеева-Клапейрона): pV=const. На графике – гипербола. Так как внутр-я эн-я ид-го газа зависит только от его темп-ры, то при изотер-ом расширении U=const и ΔU=0. По первому зак-у термод-ки: ΔQ=ΔA. Подводимое к газу при изот-ом расши-нии тепло целиком превращ-ся в работу расширения. Теплоёмкость: СT = ΔQ/ΔT==∞.
|
|
|
39. Закон равнораспределения энергии по степеням свободы. Число степеней свободы молекул. Закон равномерного распределения энергии по степени свободы. Внутренняя энергия идеального газа. Число степеней – числа независимых переменных (координат), полностью определяющих положение системы в пространстве. Независимо от общего числа степеней, три степени всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, поэтому на каждую из них приходится в среднем одинаковая энергия, равная 1/3 <ε0> < ε1>=<ε0>/3=1/2·k·T. Закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем k·T/2, а на каждую колебательную степень свободы – в среднем энергия k·T.(больше потому что потенциальная + кинетическая приходится на нее). Средняя энергия молекулы <ε>=i·k·T/2, i – сумма числа поступательных, числа числа вращательных и удвоенного чисоа колебательных степеней свободы молекулы i=iпост + iвращ + iколеб. В идеальном газе взаимная потенциальная энерия молекул равна 0 (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул: Um= i/2 · k·T·NA=i/2 · R·T. Для произвольной массы m газа U= m/M · i/2 · R·T = v · i/2 · R·T, M – молярная масса, v – количество вещества. В случае, если молекулы обладают колебательными степенями свободы, то на одну колебательную степень свободы приходится k·T. Это обьясняется тем, что на кинетическую энергию приходится 1/2 · k·T и на потенциальную 1/2 · k·T.
40. Распределение Максвелла. Среднеквадратичная и наиболее вероятная скорости, их связь с температурой. Закон Максвелла описывается некоторой ф-ей – ф-ей распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интегрвал скорости будет приходится некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Ф-ция f(v) определяет относительное число молекул dN(v) / N. Скорости которых лежат в интервале от v lдо v+dv dN(v) / N = f(v) dv f(v) = dN(v) / Ndv. Применяя методы теории вероятностей, Максвелл нашел ф-цию f(v) – закон для распределения молекул идеального газа по скоростям: f(v) = 4 • π • (m0 / (2 • π • k • T)3/2 • v2 • e – m0 • v•v / (2•k•T). Средняя скорость молекулы <v> (среднеарифметическая скорость) определяется по формуле <v> = 1/N • ∫(∞,0) v dN(v) = ∫(∞.0) v•f(v) dv. Наиболее вероятная скорость – скорость при кот-й ф-ция распределения молекул идеального газа по скоростям максимальна. Продифференцировав закон для распределения молекул идеального газа по скоростям d/dv • (v2 • e – m0 • v•v / (2•k•T)) = 2•v•(1 - m0 • v2 / (2 • k • T)) • e – m0 • v•v / (2•k•T) = 0. Искомая вероятная vв = √(2 • л • T/ m0) = √(2 • R • T /M). Средняя квадратичная скорость < vкв > = √(1/N • ∑(N, i=1) vi 2, характеризующую всю совокупность молекул газа. Физический смысл R - A = m /M · R · (T2 – T2), если T2 – T1 = 1K, то для 1 моля газа R = A, т.е. R численно равно работе изобарного расширения моля идеального газа при нагревании его на 1 К.
|
|
|
41. Испарение и конденсация. Абсолютная и относительная влажность. Испарение и конденсация, насыщенные и ненасыщенные пары: Неравномерное распределение кинетической энергии теплового движения молекул приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с остальными молекулами. Испарение – процесс, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул. Испарение сопровождается охлаждением жидкости, так как жидкость покидают молекулы, имеющие большую кинетическую энергию, и внутренняя энергия жидкости понижается. Вылетевшие молекулы начинают беспорядочно двигаться в тепловом движении газа; они могут или навсегда удалиться от поверхности жидкости, или снова вернуться в жидкость. Такой процесс называется конденсацией.
Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала процесса испарения концентрация вещества в газообразном состоянии достигает такого значения, при котором число молекул, возвращающихся в жидкость в единицу времени, становится равным числу молекул, покидающих поверхность жидкости за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
|
|
|
Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром. Пар, находящийся при давлении ниже давления насыщенного пара называется ненасыщенным: Атмосферный воздух представляет собой смесь различных газов и водяного пара. Каждый из газов вносит свой вклад в суммарное давление, производимое воздухом на находящиеся в нем тела.
Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара.
_Относительной влажностью воздуха 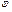 называют отношение парциального давления
называют отношение парциального давления 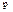 водяного пара, содержащегося в воздухе при данной температуре, к давлению
водяного пара, содержащегося в воздухе при данной температуре, к давлению  насыщенного пара при той же температуре, выраженное в процентах:
насыщенного пара при той же температуре, выраженное в процентах: 
Так как давление насыщенного пара тем меньше, чем меньше температура, то при охлаждении воздуха находящийся в нем водяной пар при некоторой температуре становится насыщенным. Температура  , при которой находящийся в воздухе водяной пар становится насыщенным, называется точкой росы.
, при которой находящийся в воздухе водяной пар становится насыщенным, называется точкой росы.
По точке росы можно найти давление водяного пара в воздухе. Она равно давлению насыщенного пара при температуре, равной точке росы. По значениям давления пара в воздухе и давления насыщенного пара при данной температуре можно определить относительную влажность воздуха.

42. Реальный газ – газ, св-ва кот-го существенно зависят от взаимодействия мол-л; когда средняя пот-я эн-я взаимодействия мол-л много меньше их средней кинет-ой эн-ии, свойства р. г. незначит-о отлич-ся от свойств идеального газа [это теоретическая модель газа, в которой пренебрегается взаимодействием частиц газа (средняя кинетическая энергия частиц много больше энергии их взаимодействия).Частицы и.г. движутся независимо друг от друга, так что давление и.г. на стенку равно сумме импульсов, переданных за единицу времени отдельными частицами при столкновениях со стенкой, а энергия — сумме энергий отдельных частиц. И.г. подчиняется уравнению состояния Клапейрона p = nkT, где р — давление, n — число частиц в единице объёма, k — Больцмана постоянная, Т — абсолютная температура] и к реальному г. применимы законы, установленные для идеального газа. Отличие свойств р. г. от идеального становится особенно значительным при высоких давлениях и низких температурах (когда начинают проявляться квантовые эффекты). Ур-е ван-дер-Ваальса. Этоур-е сост-я реального газа = ур-ю сост-я для идеального газа, но с двумя поправками. 1). Поправка на недоступный объём (непроницаемость молекул,приближённо заменяющая точную картину сил отталкивания). Мол-a ид. газа может нах-ся в любой точке сосуда V, а мол-а реал-го газа не может нах-ся там, гед расположены N-1 мол-л, и её доступна лишь часть объёма: V-b. Подсчитаем b: пусть газ не плотный, тогда пренебрегаем тройными соударениями мол-л. Для каждой пары взаимодей-их мол-л недоступной явл-ся часть, в кот-й рассто-е м/у их центрами равно d, т.е. сфера с V=4/3*Л*d3. Из N мол-л образовано пар: C2N= 0,5 * N(N-1). След-но полный недоступный объём для всех мол-л: 0,5*N(N-1)* 4/3*Л*d3≈ N2*4/6* Л*d3, и на каждую из них прих-ся: b= [4/6* Л*d3 N2]/N = 4/6*NЛd3. Тогда ур-е сост-я: p=MRT/ μ(V-b). Постоянная b пропор-на числу молей газа. 2). Поправка на “внутренне давление” (на влияние сил межмолекулярного притяжения). Сила давления газа на стенки сосуда – это рез-т столкновений мол-л с твёрдой поверхн-ью. Поэтому давл-е ид. газа прямо пропорционально концентрации мол-л: n=N/V. Так как ударяющиеся о стенки мол-ы притяг-ся всеми остальными мол-ми, то это давл-е умен-ся на p’. Сила этого притяж-я пропорц-на концен-ии мол-л: p’~N/V*N/V (так как один слой притягивает соседний слой). p’=α*N2/V2=a/ V2, где a=α*N2, где α зависит от природы газа. Пост-я а проп-на квадрату числа молей. Объединяя вторую поправку с первой: p=[MRT/ μ(V-b)]- a/ V2. – ур-е ван-дер-Ваальса. Ван-дер-Ваальса уравнение – уравнение состояния реального газа (голлан-й физик Я. Д. Ван-дер-Ваальсом (1873): Здесь: р — давление газа; Т — его температура; — объём одного моля вещества; M/μ – кол-во вещ-ва (“ню”); R — универсальная газовая постоянная; а и b — константы, учитывающие отклонение свойств реального газа от свойств идеального. Член, имеющий размерность давления, учитывает притяжение между молекулами газа за счёт ван-дер-ваальсовых сил. Константа b является поправкой на собственный объём молекул газа и учитывает отталкивание молекул на близких расстояниях. Константы а и b обычно определяются из экспериментальных данных. При больших можно пренебречь обеими поправками и ур-е в-д-Ваальса переходит в уравнение состояния идеального газа. 
Ур-е в-д-Ваальса явл-ся приближённым и количественно описывает св-ва реальных газов лишь в области высоких температур и низких давлений. Однако качественно оно позволяет описывать поведение газа при высоких давлениях, конденсацию газа в жидкость и критическое состояние.
На рис. изображено семейство изотерм (кривых зависимости р от при постоянной температуре), рассчитанных по В. у. Это уравнение, кубическое относительно, имеет три корня. При низких температурах все три корня — действительные, а выше определённой температуры Тк, называемой критической, остаётся лишь один действительный корень. Физически это означает, что при Т > Тк вещество может находиться лишь в одном (газообразном) состоянии, а ниже Тк — в трёх состояниях (двух стабильных — жидком и газообразном — и одном нестабильном). Графически это выражается так: при Т < Тк изотерма имеет три точки пересечения с прямой ac, параллельной оси объёмов. Точки прямой ac отвечают равновесию жидкости и её насыщенного пара. В условиях равновесия, например в состоянии, соответствующем точке b, относительные количества жидкости и пара определяются отношением отрезков bc / ba («правило моментов»). Равновесию фаз при определённой температуре соответствуют давление насыщенного пара рнп и интервал объёмов от до. При более низких давлениях (правее) изотерма характеризует свойства газа. Левая, почти вертикальная часть изотермы отражает очень малую сжимаемость жидкости. Участки ad и ес относятся соответственно к перегретой жидкости и переохлажденному пару (метастабильные состояния). Участок de физически неосуществим, так как здесь происходит увеличение объёма при увеличении давления. Совокупность точек а, a', а»... и с, c', с»... определяет кривую, называемую бинодалью, которая очерчивает область совместного существования газа и жидкости. В критической точке К температура, давление и объём (Тк, рк,) имеют значения, характерные для каждого вещества. Однако, если в В. у. ввести относительные величины: Т/Тк, Р/рк и, то можно получить так называемое приведённое В. у., которое является универсальным, то есть не зависит от индивидуальных свойств вещества.
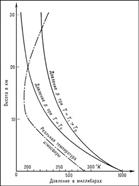
43. Барометрическая формула определяет зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру Т и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), Б. ф. имеет следующий вид: р = p 0 e ^ [- g m. (h - h0) /RT ] (1), где р – давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне, m — молек-я масса газа, R – газовая постоянная, Т — абс темп-а. Графически завис-ть (1) представлена на рис. Из Б. ф. (1) следует, что конц-ия мол-л n (или плотн-ть газа) убывает с высотой по тому же закону: n = n0 e ^ [- mg (h-h0) /kT ], Б. ф. может быть получена из закона распредел-ия мол-л ид-го газа по скоростям и координатам в потенц-ом силовом поле. При этом должны выполняться 2 условия: T газа = const и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Б. ф. показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина — mg (h-h0) /kT, определяющая быстроту спада плотности, представляет собой отнош-е пот-ой энергии частиц к их средней кинет-й эн-ии, пропорцион-ой kT. Чем выше Т, тем медленнее убывает плотность с высотой. Но возрастание силы тяжести mg (при T=const) приводит к значительно большему уплотнению нижних слоев и увелич-ю перепада (градиента) плотности. Действующая на частицы сила тяжести mg может изм-ся за счёт двух величин: g и массы частиц m. След-но, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте. Реальное распред-е давл-я и плотности воздуха в земной атмосфере не следует Б. ф., т.к. в пределах атмосферы Т и g меняются с высотой и географ-й широтой.
44. Первое начало термодинамики. Работа, совершаемая газом при изменении объёма. Первый з-н термодинамики: кол-ва тепла (ΔQ), сообщённое системе, идёт на приращение внутренней энергии (ΔU) системы и на совршение системой работы (ΔA) над внешними телами. [1 калория = 4,18 Дж]. Δ’Q=ΔU+Δ’A. ΔU – приращение внутр-й эн-ии, а Δ’Q и Δ’A – элементарное кол-во теплоты и работы. Чтобы произвести вычисл-ия перейдём к диффиринциалам: d’Q=dU+d’A, тогда: Q=(U2-U1)+A. (Q – кол-во теплоты, U1-U2 – нач-е и кон-е знач-я внутр-й эн-ии системы, A – совершённая системой работа). Работа, совершаемая газом при изменении объёма. Пусть газ заключен в цилиндр и закрыт поршнем. Пусть газ расширился и переместил поршень на Δh, т.е. газ совер-л работу при этом: Δ’A=F*Δh. (F – сила, с кот-й газ действует на поршень и F=p*S), тогда: Δ’A=pS*Δh. Но S*Δh представляет собой приращение ΔV. Тогда: Δ’A= p*ΔV.
45. Теплоёмкость. Теплоёмкость идеал-х газов. Теплоёмкость – величина, равная кол-ву тепла, кот-ое нужно сообщить телу, чтобы повысить его темпе-у на один кельвин: Стела=d’Q/dT (по опред-ю) = [Дж/К]. Молярная теплоёмкость – теплоёмкость моля вещ-ва (С=[ДЖ/моль*К]), Удельная теплоёмкость – теплоёмкость единицы массы вещ-ва (с=[ДЖ/кг*К]). с=C/M, где M – молярная масса. Сv/Cp – теплоёмкости при постоянном объёме/давлении. Если нагревание при V=const, то тело не сов-т работы, след-но тепло идёт на приращ-е внутр-ей эн-ии: d’Qv=dU, отсюда: Сv=(∂U/∂T)v. Или: Сv=dUm/dT (чтобы получить мол-ую теплоёмкость нужно взять внутр-юю энергию моля газа). Из первого начала термодинамики: d’Qp=dUM+pdVM. Поделим его на dT: Cp = dUM/dT+p(∂VM/∂T)p. Так как Сv=dUm/dT, то Cp =Сv + p(∂VM/∂T)p. Величина (∂VM/∂T)p представляет собой приращение объёма моля газа при повышении температуры на один кельвин (когда p=const). По ур-ю сост-я: VM=RT/p, тогда: дифференцируем последнее выраж-е по Т (причём p=const): (∂VM/∂T)p=R/p. Тогда получим: Cp= CV+R.
След-но, работа, кот-ю совер-т моль ид-го газа при повышении его темпер-ры на один кельвин при p=const, оказ-ся равной R.
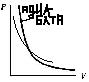
 46. Адиабатические процессы. Ур-е адиабаты. Адиаб-й процесс – процесс, протикающий без теплообмена с внешней средой. Для одноатомных газов (аргона, неона и др.) при обычных температурах γ = 1,67, для двухатомных (водорода, азота, кислорода и др.) γ = 1,4. Рис. даёт А. для γ = 1,4. Ур-е адиабаты (ур Пуассона): pVγ=const (1). Ур-е изотермы: pV=const (2), сопоставив 1 и 2 ур-я: адиабата идёт круче, чем изотерма. Дифференци-е ур-я 2: p*dV + V*dp=0, отсюда для изотермы: dp/dV=-p/V. Диффир-я ур-е 1: pγVγ -1dV + Vγdp=0, отсюда: dp/dV=-γp/V. Значит, тангенс угла наклона адиабаты в γ раз больше, чем у изотермы.
46. Адиабатические процессы. Ур-е адиабаты. Адиаб-й процесс – процесс, протикающий без теплообмена с внешней средой. Для одноатомных газов (аргона, неона и др.) при обычных температурах γ = 1,67, для двухатомных (водорода, азота, кислорода и др.) γ = 1,4. Рис. даёт А. для γ = 1,4. Ур-е адиабаты (ур Пуассона): pVγ=const (1). Ур-е изотермы: pV=const (2), сопоставив 1 и 2 ур-я: адиабата идёт круче, чем изотерма. Дифференци-е ур-я 2: p*dV + V*dp=0, отсюда для изотермы: dp/dV=-p/V. Диффир-я ур-е 1: pγVγ -1dV + Vγdp=0, отсюда: dp/dV=-γp/V. Значит, тангенс угла наклона адиабаты в γ раз больше, чем у изотермы.



 47. Работа в изопроцессах. 1. Изохорический процесс – объём газа остаётся постоянным, меняются p и T, нагревание газа в замкнутом объёме. Так как V=const, то ΔV=0 и ΔA=p*ΔV=0. При изохорич-ом процессе газ не сов-т работы: ΔQ=ΔU, – все сообщаемое газу тепло идёт на увеличение его внутр-й эн-ии. Молярная теплоёмк-ть: Сv = ΔQ/ΔT= ΔU/ΔT. 2. Изобарический процесс – процесс, проходящий при пост-ом давлении. Работа при изоб-ом расши-нии изобр-ся на графике площадью прямоугольника. ΔA=p*ΔV =p*(V2-V1). Подводимое к газу тепло частиыно тратится на увелич-е внутр-й эн-ии (на нагревание), а частично – на совершение работы. Молярная теплоёмк-ть: Сv = ΔQ/ ΔT= ΔU/ΔT+ΔA/ΔT. 3. Изотермический процесс. – процесс, проводимый при пост-й темп-ре газа. Из ур сост-я (Менделеева-Клапейрона): pV=const. На графике – гипербола. Так как внутр-я эн-я ид-го газа зависит только от его темп-ры, то при изотер-ом расширении U=const и ΔU=0. По первому зак-у термод-ки: ΔQ=ΔA. Подводимое к газу при изот-ом расши-нии тепло целиком превращ-ся в работу расширения. Теплоёмкость: СT = ΔQ/ΔT= ΔQ/0=∞.
47. Работа в изопроцессах. 1. Изохорический процесс – объём газа остаётся постоянным, меняются p и T, нагревание газа в замкнутом объёме. Так как V=const, то ΔV=0 и ΔA=p*ΔV=0. При изохорич-ом процессе газ не сов-т работы: ΔQ=ΔU, – все сообщаемое газу тепло идёт на увеличение его внутр-й эн-ии. Молярная теплоёмк-ть: Сv = ΔQ/ΔT= ΔU/ΔT. 2. Изобарический процесс – процесс, проходящий при пост-ом давлении. Работа при изоб-ом расши-нии изобр-ся на графике площадью прямоугольника. ΔA=p*ΔV =p*(V2-V1). Подводимое к газу тепло частиыно тратится на увелич-е внутр-й эн-ии (на нагревание), а частично – на совершение работы. Молярная теплоёмк-ть: Сv = ΔQ/ ΔT= ΔU/ΔT+ΔA/ΔT. 3. Изотермический процесс. – процесс, проводимый при пост-й темп-ре газа. Из ур сост-я (Менделеева-Клапейрона): pV=const. На графике – гипербола. Так как внутр-я эн-я ид-го газа зависит только от его темп-ры, то при изотер-ом расширении U=const и ΔU=0. По первому зак-у термод-ки: ΔQ=ΔA. Подводимое к газу при изот-ом расши-нии тепло целиком превращ-ся в работу расширения. Теплоёмкость: СT = ΔQ/ΔT= ΔQ/0=∞.
48. Второе начало термодинамики. Равновесные процессы. Обратимые процессы. Цикл Карно. впервые отмеченное Карно в 1824 году, привело в 1850 - 1851 годах к формулировке второго начала термодинамики, дающего ограничение на направление протекания термодинамических процессов. Первая формулировка второго начала термодинамики была дана в 1850 году Рудольфом Юлиусом Эмануэль Клаузиусом (1822 - 1888) в следующем виде: "Теплота сама по себе не может перейти от более холодного тела к более теплому". Несколько иная формулировка второго начала термодинамики была предложена в 1851 году Томсоном (лордом Кельвином): "В природе не возможен круговой процесс, единственным результатом которого была бы механическая работа, совершаемая за счет отвода теплоты от теплового резервуара".
Системой тел или просто системой мы будем называть совокупность рассматриваемых тел. Примером системы может служить жидкость и находящийся в равновесии с ней пар. В частности, система может состоять из одного тела. Всякая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом и т. д. Подобные величины, характеризующие состояние системы, называются параметрами состояния. Не всегда какой-либо параметр имеет определенное значение. Если, например, температура в разных точках тела неодинакова, то телу нельзя приписать определенное значение параметра Т. В этом случае состояние называется неравновесным. Процесс перехода системы из неравновесного состояния в равновесное называется процессом релаксации или просто релаксацией. Равновесным состоянием системы называется такое состояние, при котором все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго. Всякий процесс, т. е. переход системы из одного состояния в другое, связан с нарушением равновесия системы. Следовательно, при протекании в системе какого-либо процесса она проходит через последовательность неравновесных состояний. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным или квазистатическим. Из сказанного следует, что равновесным может быть только бесконечно медленный процесс. При достаточно медленном протекании реальные процессы могут приближаться к равновесному сколь угодно близко. Равновесный процесс может быть проведен в обратном направлении, причем система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Поэтому равновесные процессы называют также обратимыми. Процесс, при котором система после ряда изменений возвращается в исходное состояние, называется круговым процессом или циклом. Все количественные выводы термодинамики строго применимы только к равновесным состояниям и обратимым процессам.
3.7.Термодинамический цикл Карно
При первом изотермическом процессе 1-2 происходит передача рабочему телу теплоты Q1, причем эта теплота передается бесконечно медленно, при практически нулевой разнице температуры между нагревателем и рабочим телом. Далее рабочее тело подвергается адиабатическому расширению без теплообмена с окружающей средой (процесс 2-3). При последующем изотермическом процессе 3-4 холодильник забирает у рабочего тела теплоту Q’2. Процесс 4-1 представляет собой адиабатическое сжатие, переводящее рабочее тело в первоначальное состояние.
Рассчитаем к.п.д. цикла Карно в случае, если в качестве рабочего тела используется идеальный газ, масса которого равна M. Уравнение адиабаты для переменных температура T и объем V имеет вид (см. формулу (2.86)): TV ץ-1 = const (3.6)
Применение этого уравнения к процессам 2-3 и 4-1 позволяет получить условия
T1V2 ץ-1 = T2V3 ץ-1 (3.7) T1V1 ץ-1 = T2V4 ץ-1 (3.8)
Деление выражения (3.7) на (3.8) дает
V2/V1=V3/V4
Учитывая, что процессы 1-2 и 3-4 являются изотермическими и, следовательно, происходят без изменения внутренней энергии газа, для получаемой Q1и отдаваемой Q’2 теплоты на основании первого начала термодинамики (1.4) и формулы (2.116) можно записать

| (3.10) |

| (3.11) |
Подстановка полученных выражений в формулу (3.2) дает выражение

| (3.12) |
которое, в свою очередь, с учетом соотношения (3.9), преобразуется к виду:

| (3.13) |
Полученное выражение позволяет определить коэффициент полезного действия цикла Карно обратимой тепловой машины, если в ней в качестве рабочего тела используется идеальный газ. Из приведенных формул следует, что к.п.д. такой тепловой машины всегда меньше единицы и полностью определяется температурами нагревателя и холодильника.
КПД цикла Карно.

|
| Рис. 3.7. Термодинамический цикл Карно |
При первом изотермическом процессе 1-2 происходит передача рабочему телу теплоты Q1, причем эта теплота передается бесконечно медленно, при практически нулевой разнице температуры между нагревателем и рабочим телом. Далее рабочее тело подвергается адиабатическому расширению без теплообмена с окружающей средой (процесс 2-3). При последующем изотермическом процессе 3-4 холодильник забирает у рабочего тела теплоту Q’2. Процесс 4-1 представляет собой адиабатическое сжатие, переводящее рабочее тело в первоначальное состояние.
Рассчитаем к.п.д. цикла Карно в случае, если в качестве рабочего тела используется идеальный газ, масса которого равна M. Уравнение адиабаты для переменных температура T и объем V имеет вид (см. формулу (2.86)): TV ץ-1 = const (3.6)
Применение этого уравнения к процессам 2-3 и 4-1 позволяет получить условия
T1V2 ץ-1 = T2V3 ץ-1 (3.7) T1V1 ץ-1 = T2V4 ץ-1 (3.8)
Деление выражения (3.7) на (3.8) дает
V2/V1=V3/V4
Учитывая, что процессы 1-2 и 3-4 являются изотермическими и, следовательно, происходят без изменения внутренней энергии газа, для получаемой Q1и отдаваемой Q’2 теплоты на основании первого начала термодинамики (1.4) и формулы (2.116) можно записать
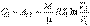
| (3.10) |
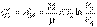
| (3.11) |
Подстановка полученных выражений в формулу (3.2) дает выражение

| (3.12) |
которое, в свою очередь, с учетом соотношения (3.9), преобразуется к виду:

| (3.13) |
Полученное выражение позволяет определить коэффициент полезного действия цикла Карно обратимой тепловой машины, если в ней в качестве рабочего тела используется идеальный газ. Из приведенных формул следует, что к.п.д. такой тепловой машины всегда меньше единицы и полностью определяется температурами нагревателя и холодильника.
50. Энтропия. Закон возрастания энтропии. Понятие термодинамической энтропии, впервые введенное в 1865 году Клаузиусом, имеет ключевое значение для понимания основных положений термодинамики.
Рассмотрим обратимый круговой термодинамический процесс, представленный на рис. 3.12. Для этого процесса может быть записано равенство Клаузиуса (3.49) в виде
 , ,
| (3.50) |
где первый интеграл берется по траектории I, а второй - соответственно по траектории II.

|
| Рис. 3.12. Обратимый круговой термодинамический процесс |
Изменение направления протекания процесса 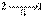 на противоположное
на противоположное  , что можно выполнить вследствие обратимости процесса II, приводит к замене знака перед вторым интегралом формулы (3.50). Выполнение этой замены и перенос второго интеграла в выражении (3.50) в правую часть дают
, что можно выполнить вследствие обратимости процесса II, приводит к замене знака перед вторым интегралом формулы (3.50). Выполнение этой замены и перенос второго интеграла в выражении (3.50) в правую часть дают

| (3.51) |
Из полученного выражения следует, что для обратимых процессов интеграл  не зависит от конкретного вида траектории, по которой происходит процесс, а определяется только начальным и конечным равновесными состояниями термодинамической системы.
не зависит от конкретного вида траектории, по которой происходит процесс, а определяется только начальным и конечным равновесными состояниями термодинамической системы.
С аналогичной ситуацией мы уже встречались, когда в механике рассматривали определение работы консервативной силы. Независимость работы консервативной силы от формы траектории движения тела позволила ввести функцию, названную потенциальной энергией, которая зависит только от состояния механической системы и не зависит от того, как в это состояние система была переведена.
Из этой аналогии следует, что элементарное приведенное количество теплоты 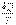 должно представлять собой полный дифференциал некоторой функции S, зависящей только от состояния термодинамической системы, то есть:
должно представлять собой полный дифференциал некоторой функции S, зависящей только от состояния термодинамической системы, то есть:
 . .
| (3.52) |
Тогда интеграл  будет равен разности значений функции Sв равновесных состояниях 1 и 2:
будет равен разности значений функции Sв равновесных состояниях 1 и 2:
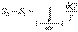 . .
| (3.53) |
Итак, величина  является функцией, зависящей только от равновесного состояния термодинамической системы. Она не зависит от конкретного вида термодинамического процесса, приведшего систему в указанное состояние. Эта функция была названа Клаузиусом термодинамической энтропией
является функцией, зависящей только от равновесного состояния термодинамической системы. Она не зависит от конкретного вида термодинамического процесса, приведшего систему в указанное состояние. Эта функция была названа Клаузиусом термодинамической энтропией
3.9. Закон возрастания энтропии
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 3.13.

Пусть процесс  будет необратимым, а процесс
будет необратимым, а процесс  - обратимым. Тогда неравенство Кла
- обратимым. Тогда неравенство Кла
|
|
|


