 |
Привило фаз (закон Гиббса)
|
|
|
|
КРАТКИЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ
Общие сведения о диаграммах фазового равновесия
Диаграммы фазового равновесия, или диаграммы состояния, в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним.
Равновесное состояние соответствует минимальному значению энергии Гиббса. Это состояние может быть достигнуто только при очень малых скоростях охлаждения или длительном нагреве. В связи с этим рассмотрение диаграмм состояния позволяет определить фазовые превращения в условиях очень медленного охлаждения или нагрева. Истинное равновесие в практических условиях достигается редко. В подавляющем числе случаев сплавы находятся в метастабильном состоянии, т. е. в таком состоянии, когда они обладают ограниченной устойчивостью и под влиянием внешних факторов переходят в другие более устойчивые состояния, так как их энергия Гиббса больше минимальной. Для целей практики важно, что метастабильные состояния нередко сообщают сплавам высокие механические и другие свойства. В этом случае необходимо установить природу метастабильных состояний, обеспечивающих оптимальный комплекс свойств, и разработать режим термической или какой-либо другой обработки, позволяющей получить эти неравновесные состояния. Исходным положением при решении этих задач является знание диаграмм фазового равновесия.
Существует несколько видов диаграмм состояния в зависимости от количества компонентов в системе.
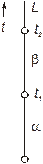
|
| Рисунок 1 – Изменение агрегатного состояния однокомпонентной системы в зависимости от температуры |
|
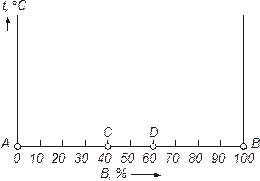
| Рисунок 2 – Координаты для изображения состояний двухкомпонентной системы |
Если система однокомпонентна, то диаграмма состояния будет иметь одно измерение (шкала температур) и соответствующие точки на прямой покажут равновесную температуру изменения агрегатного состояния.
|
|
|
Если в системе два компонента, то второе измерение покажет концентрацию сплава: диаграмму строят в двух измерениях (температура-концентрация).
По сои ординат откладывают температуру, по оси абсцисс – концентрацию. Общее содержание обоих компонентов в сплаве равно 100 %, и каждая точка на оси абсцисс соответствует определенному содержанию каждого компонента. В точке С 40 % В и 60 % А; в точке D 60 % В и 40 % А и т. д. По мере удаления от точки А увеличивается количество компонента В и в точке В его будет 100 %. Следовательно, крайние ординаты на диаграмме соответствуют чистым компонентам, а ординаты между ними – двойным сплавам.
Диаграмма состояния сплавов с тремя компонентами имеет пространственный вид (две оси концентрационные и одна температурная). Четырехкомпонентную систему и систему с большим числом компонентов также изображают в виде пространственных диаграмм, но с некоторым упрощением, так как они имеют больше трех независимых переменных. Каждая точка на диаграмме состояния показывает состояние сплава данной концентрации при данной температуре. Каждая вертикаль соответствует изменению температуры определенного сплава. Изменение фазового состояния сплава отмечается на диаграмме точкой. Линии, соединяющие точки аналогичных превращений, разграничивают на диаграмме области аналогичных фазовых состояний.
Вид диаграммы состояния зависит от того, как реагируют оба компонента друг с другом в твердом и жидком состояниях, т.е. растворимы ли они в твердом и жидком состояниях, образуют ли они химические соединения и т.д.
|
|
|
Привило фаз (закон Гиббса)
Диаграммы фазового равновесия характеризуют окончательное или предельное состояние сплавов, т.е. полученное после того, как все превращения в них произошли и полностью закончились. Это состояние сплава зависит от внешних условий (температуры, давления, концентрации) и характеризуется числом и концентрацией образовавшихся фаз.
|
|
|
12 |


