 |
Физико-химнческне параметры элементов
|
|
|
|
| Элемент | Валентное состояниеW | Радиус ионовRi. 10 нм | Ионный потенциалW/R, | Электроотрицательность, кДж/моль |
| Катионогенные элементы (преобладающие состояния Меn+) | ||||
| Li | 1 + | 0,68 | 1,47 | |
| Na | 1 + | 0,98 | 1,02 | |
| К | 1 + | 1,33 | 0,752 | |
| Rb | 1 + | 1,49 | 0,671 | |
| Cs | 1 + | 1,65 | 0,606 | |
| Ca | 2 + | 1,04 | 1,92 | |
| Sr | 2 + | 1,20 | 1,67 | |
| Ba | 2 + | 1,38 | 1,45 | |
| Элементы-комплексообразователи 8-электронные или с малым числом d-электронов (преобладающие состояния Men+, MeFnm-, Ме(СO3)nm-, МеОНnm-) | ||||
| Mg | 2 + | 0,74 | 2,7 | |
| Be | 2 + | 0,34 | 5,89 | |
| Al | 3 + | 0,57 | 5,26 | |
| Sc | 3 + | 0,83 | 3,62 | |
| Y | 3 + | 0,97 | 3,1 | |
| La | 3 + | 1,03 | 2,88 | |
| Ce | 3 + | 1,02 | 2,94 | |
| Ce | 4 + | 0,88 | 4,55 | |
| Прочие редкоземельные элементы | 3 + | 0,80-1,0 | 3,0-3,75 | 636-800 |
| Ti | 4 + | 0,64 | 6,25 | |
| Zr | 4 + | 0,82 | 4,88 | |
| Nb | 5 + | 0,66 | 7,6 | |
| Та | 5 + | 0,66 | 7,6 | |
| 18-электронные (преобладающие состояния Men+, МеInm-, NeBrnm-, МеС1nm-, Me(SO4)nm-, Me(HS), МеОНnm-, Me(CO3)nm-) | ||||
| Сu | 1 + | - | ||
| Сu | 2 + | 0,80 | 2,5 | |
| Ag | 1 + | 1,13 | 0,89 | |
| Аu | 1 + | 1,37 | 0,73 | |
| Аu | 3 + | 0,85 | 3,5 | |
| Zn | 2 + | 0,83 | 2,41 | |
| Cd | 2 + | 0,99 | 2,02 | |
| Hg | 2 + | 1,12 | 1,78 | |
| Pb | 4 + | 0,76 | 5,26 | |
| Pb | 2 + | 1,26 | 1,59 | |
| Bi | 3 + | 1,20 | 2,5 | |
| Переходные (преобладающие состояния Men+, МеОНnm, Me(SO4)nm и др.) | ||||
| Мn | 2 + | 0,91 | 2,2 | |
| Мn | 3 + | 0,70 | 4,29 | |
| Fe | 2 + | 0,80 | 2,5 | |
| Fe | 3 + | 0,67 | 4,48 | |
| Элемент | Валентное состояниеW | Радиус ионовRi 10 нм | Ионный потенциалW/R, | Электроотрицательность, кДж/моль |
| Аниогенные элементы образующие простые анионы А- и анионы с кислородом МеOnm- (элементы с малым числом электронов, 8-электронные и тяготеющие к ним переходные элементы) | ||||
| B | 3 + | 0,21 | 14,29 | |
| C | 4 + | 0,20 | 20,0 | |
| Si | 4 + | 0,39 | 10,26 | |
| N | 5 + | 0,15 | 33,3 | |
| Р | 5 + | 0,35 | 14,3 | |
| V | 5 + | 0,60 | 8,83 | |
| S | 6 + | 0,30 | 20,0 | |
| Se | 4 + | 0,69 | 5,8 | |
| Se | 6 + | 0,35 | 17,14 | |
| W | 6 + | 0,65 | 9,23 | |
| Fe | 7 + | 0,07 | 100,0 | |
| CI | 7 + | 0,26 | ||
| Br | 7 + | 0,39 | 17,9 | |
| I | 7 + | 0,50 | ||
| Образующие анионы с кислородом МеОnm- и серой MeSnm- (18-электронные элементы) | ||||
| Ge | 4 + | 0,44 | 9,1 | |
| As | 5 + | 0,47 | 10,6 | |
| Sb | 5 + | 0,62 | 8,06 |
Поля устойчивости соединений меди (а), цинка (б), свинца (в) в виде функции Eh-pH
|
|
|
Частицы, мигрирующие во взвешенной (механической) форме, имеют размеры от 0,0001 до 0,001 мм. В этой форме переносятся наиболее устойчивые минералы в тонкодисперсном виде, образующие россыпи при отложении из водных потоков (Au, Sn, HgS и др.).
Коллоидные частицы имеют размеры от 10-5 до 10-7 см и образуются при диспергировании и соединении молекулярных частиц. Это промежуточная форма состояния вещества между кристаллическим и истинным раствором.
Соединения Si, Al, Ti, Mn, Fe, составляющие до 84 % массового объема литосферы, плохо растворимы и образуют коллоидные осадки (золи, гели). Большая часть соединений Mn, As, Zr, Mo, Ti, V, Cr мигрирует в коллоидной форме. В этой форме часто мигрируют Сu, Zn, Pb, Ni, Со, Sn. Коллоиды сорбируют ионы и молекулы из растворов. Главными сорбентами являются гумусовые вещества, минеральные коллоиды (глина, SiO2, Fe(OH)3, А1(ОН)3, МnO2 и др.).
Для растворенной формы миграции вещества характерны размеры частиц менее 10-7 мм. При этом миграция может происходить в виде нейтральных молекул, простых, сложных и комплексных ионов.
Нейтральные молекулы неорганических соединений образуются при взаимодействии разнозаряженных ионов (ZnSO4, CuCl2, CuSO4, ZnCl2, HgCl2, NiS04, CaCl2, FeCl3, MnSO4 и др.). Нейтральные органические комплексы (соединения металлов с органическими кислотами) изучены плохо, но их роль в миграции металлов, особенно в почвенном слое, видимо, весьма велика.
Ионные формы представлены простыми (Сu2+, Pb2+, Zn2+ и др.), сложными ( и др.) и комплексными ионами. В зависимости от физико-химической обстановки ионы могут менять свой знак. Например, цинк, медь, свинец, никель мигрируют в кислых водах в виде простых катионов, а в слабо кислых и щелочных водах в виде отрицательно заряженных или нейтральных комплексных соединений.
и др.) и комплексными ионами. В зависимости от физико-химической обстановки ионы могут менять свой знак. Например, цинк, медь, свинец, никель мигрируют в кислых водах в виде простых катионов, а в слабо кислых и щелочных водах в виде отрицательно заряженных или нейтральных комплексных соединений.
|
|
|
Комплексные соединения являются наиболее широко распространенной формой миграции. Они образуются при взаимодействии ионов металла-комплексообразователя с полярными молекулами или ионами противоположного заряда. Возникающие при этом химические связи не обусловлены образованием новых электронных пар. Центральное место в комлексном соединении занимает положительный ион-комплексообразователь. Непосредственно вокруг него размещено или координировано некоторое количество полярных молекул или отрицательных ионов, называемых аддендами. В водном растворе комплексное соединение диссоциирует на комплексный ион и ионы внешней сферы (противоионы).
В нашей стране и за рубежом разработано большое количество компьютерных программ для расчета термодинамических равновесий при взаимодействии вода ↔ порода и установлении форм водной миграции вещества в широком диапазоне колебания величин Eh-pH.
Основные процессы формирования химического состава подземных вод рудных месторождений. Формирование химического состава подземных вод на участках рудных месторождений определяется сернокислотными, окислительными, а также углекислотными и гидролитическими процессами. Эти процессы подробно описаны в работах [5, 12, 19, 21].
Сернокислотное выветривание характерно для месторождений сульфидного типа – медно-колчеданных, полиметаллических и др. Растворимость моносульфидов (сфалерита, галенита, киновари и др.) в воде весьма невелика и не превышает тысячных долей миллиграмма на литр. Она повышается у дисульфидов (пирит, марказит, арсенопирит, молибденит), которые дают при растворении в окислительной обстановке свободную серную кислоту:
2FeS2 + 702 + 2H20 → 2Fe2+ +4Н+ + 4  .
.
Серная кислота переводит сульфиды в сульфаты:
MeS + 2Н+ +  → H2S + Me2+ +
→ H2S + Me2+ + 
Этим самым интенсифицируются процессы разложения сульфидов и выноса продуктов их разрушения.
При окислении моносульфидов образуются только сульфаты:
MeS + 202 → MeS04.
При воздействии на сульфиды металлов сульфат окиси железа восстанавливается до сульфата закиси железа. В свою очередь он окисляет сульфиды до сульфатов с образованием серной кислоты:
|
|
|
2MeS + 4Fe3+ + 302 + 2H20 → 2Me2 + + 4Fe2+ + 4H+ +  .
.
Сульфат меди, образующийся при окислении сульфидов меди, окисляет другие сульфиды:
MeS + Cu2+ +  → Ме2+ +
→ Ме2+ +  + CuS.
+ CuS.
Поскольку сульфидные тела, как правило, содержат сульфиды железа и меди, схема преобразования химического состава подземных вод на участках сульфидных месторождений примерно одинакова. В итоге подземные воды обогащаются серной кислотой, сульфатами металлов и сероводородом. В зоне трещинно-грунтовых вод они приобретают следующие основные особенности: 1) повышенное содержание сульфат-иона; 2) кислую реакцию воды; 3) повышенные концентрации металлов; 4) повышенную минерализацию вод; 5) высокие значения окислительно-восстановительного потенциала (до нескольких сотен милливольт); 6) пониженные концентрации гидрокарбонат-иона, вплоть до полного его исчезновения из раствора и накопления углекислоты; 7) соответствующий биоценоз микрофлоры, сопровождающийся активной деятельностью железобактерий и некоторых групп тионовых бактерий, участвующих в окислительных процессах; 8) несколько повышенную температуру подземных вод в ряде случаев (на несколько градусов по сравнению с фоном), поскольку реакции окисления сульфидов проходят с выделением тепла.
Степень проявления указанных выше особенностей подземных вод зависит от стадии окисления сульфидных месторождений. С.С. Смирнов выделил следующие стадии развития зоны окисления сульфидных месторождений.
Начальная стадия – сульфидные и другие гипогенные минералы только еще начинают изменяться. Новообразований мало и они по преимуществу представлены продуктами окисления и растворения сульфидов сульфатами, а также некоторыми оксидами и гидроксидами.
Средняя стадия – супергенный материал преобладает над гипогенным. Большинство сульфидов окислено, но часть их еще присутствует в рудах. Сульфатов в растворах и твердой фазе достаточно много. Наряду с ними развиваются карбонаты, оксиды, гидроксиды, силикаты и др.
|
|
|
В процессах окисления и растворения помимо кислорода активное участие принимают H2S04, Fe2(S04)3, CuS04 и др. Происходит вынос преимущественно в сульфатной форме.
Конечная стадия – сульфидов уже почти нет,  в водах почти исчезает. Главное значение приобретают
в водах почти исчезает. Главное значение приобретают 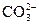 , SiО2 и т.д. Сульфаты заменяются карбонатами, силикатами и другими, не содержащими серы, кислородными соединениями. Вынос тяжелых металлов происходит в виде R(HCО3)n.
, SiО2 и т.д. Сульфаты заменяются карбонатами, силикатами и другими, не содержащими серы, кислородными соединениями. Вынос тяжелых металлов происходит в виде R(HCО3)n.
Разрез сульфидного месторождения в конечной стадии окисления С.С. Смирнов представил в следующем виде: 1) поверхностный слой; 2) подзона окисленных руд; 3) подзона окисленных выщелоченных руд; 4) подзона богатых окисленных руд; 5) зона вторичного обогащения сульфидных руд; 6) зона сульфидных гипогенных руд.
Наиболее заметные изменения состава подземных вод наблюдаются на средних стадиях окисления сульфидных тел и приурочены к верхним их подзонам. С глубиной подземные воды теряют многие специфические черты. Так, в восстановительной обстановке инфильтрующиеся из зоны окисления кислые сульфатные воды, вступая во взаимодействие с сульфидами, приобретают нейтральную и даже щелочную реакцию, теряют в осадок значительную часть растворенных металлов, накапливают сероводород.
Процессы кислородного окисления руд и минералов, по Г.А. Голевой [12], являются более широко распространенными по сравнению с сернокислотными. В результате этих процессов образуется не свободная серная кислота, а накапливаются вторичные кислородсодержащие минералы.
В этих условиях формируются слабокислотные воды (рН не менее 6) с Eh 0,4-0,5 В, повышенными содержаниями сульфат-иона и металлов.
Углекислотное выветривание характерно для месторождений несульфидных руд. Схематично эти процессы могут быть показаны реакцией
MeSiO3 + 2С02 + 2Н2 О = Ме2+ +  .
.
Наиболее благоприятные условия для миграции металлов возникают в силикатных породах. Уменьшение содержания свободной углекислоты приводит к выпадению в осадок карбоната кальция, а вместе с ним и многих металлов.
Гидролитическое разложение рудных соединений является главным геохимическим процессом в районах развития «безуглекислых» вод с весьма малой минерализацией. Такие условия наблюдаются преимущественно в горных областях.
Весьма способствуют накоплению металлов в водах процессы электрохимического растворения.
По Г.Б. Свешникову, сульфидное рудное тело представляет собой сложный электрод, состоящий из отдельных минеральных электродов, имеющих относительно положительные и отрицательные значения электродного потенциала. По убыванию величины стационарного электродного потенциала установлен такой ряд сульфидов: марказит – пирит – ковеллин – халькопирит – арсенопирит – борнит – халькозин – пирротин – галенит – пентландит – шмальтин – молибденит – сфалерит.
|
|
|
Взаимодействие руд и вод, обладающих разными потенциалами, вызывает образование электрических токов, которые активно способствуют электрохимическому растворению рудных минералов. Растворяются обычно те металлы, сульфиды которых являются анодом. Например, при совместном нахождении пирита, халькопирита, галенита и сфалерита первые два минерала – катоды, а последние два – аноды. Поэтому вода обогащается свинцом и цинком, а медь и железо практически не растворяются. Электрохимическое растворение происходит как в кислой, так и в нейтральной и щелочной среде, как в зоне окисления, так и в зоне восстановления.
В результате электрохимического растворения сульфидных руд происходит накопление металлов в водах. Так, если обычная растворимость отдельных сульфидов не превышает долей миллиграмма на литр, то в результате электрохимического растворения и других гидрохимических процессов, проходящих в сульфидных рудных телах, содержание металлов в водах достигает многих миллиграммов на литр.
Из других процессов, оказывающих влияние на формирование гидрогеохимических ореолов, следует отметить осмотические, криогенные и микробиологические процессы.
Осмотические процессы происходят при контакте растворов разных концентраций через полупроницаемую перегородку, которая пропускает молекулы растворителя, но не растворенного вещества. Роль подобной перегородки могут выполнять ткани живых организмов. Разновидностями осмоса являются термоосмос (движение воды в пленках под влиянием разности температур) и капиллярный осмос (передвижение воды в капиллярах вследствие разности концентрации на разных расстояниях от поверхности раздела вода – минерал). Последнее явление имеет большое значение, особенно для глинистых пород. В результате осмоса происходит увеличение концентрации солей в водах.
Д.С. Коржинский установил наличие «фильтрационного эффекта», заключающегося в отставании растворенного вещества от растворителя при движении раствора через пористую среду. Плотные породы, пропускающие растворитель, могут оказаться непреодолимой преградой для некоторых растворенных веществ. Осмотические процессы являются одной из причин разной дальности миграции рудных компонентов, зональности гидрогеохимических ореолов и потоков рассеяния.
В условиях распространения многолетней мерзлоты миграция рудных компонентов обусловлена прежде всего воздействием на рудные соединения тонких пленок воды, адсорбируемых на поверхности пород и незамерзающих при очень низких отрицательных температурах. Эта влага химически активна и может передвигаться под действием термодиффузионного эффекта. В холодный период года происходит промерзание деятельного слоя, а в теплый – его оттаивание. Эти явления вызывают образование направленных потоков пленочных вод. Адсорбированные ионы, переходящие в раствор, перемещаются к холодному фронту – зимой кверху, к земной поверхности, вынося при этом компоненты из верхней зоны многолетнемерзлых пород, а летом вниз, по потоку. Способность ионов к криогенной миграции тем больше, чем меньше валентность и меньше радиус иона. Л.Д. Белова и 3.С. Лесанов выделяют следующий ряд подвижности катионов: Ti > Pb, Fe, Al, Ni, Cu > Ag, V, Ga > Mo, U, Cr, Mn. Они же дали ориентировочную оценку выноса рудного вещества пленочными водами (до 40 % от общего количества металла, переносимого поверхностными водами). Это указывает на весьма важную роль криогенных процессов в формировании гидрогеохимических ореолов.
Гидрогеохимические потоки и ореолы рассеяния являются наиболее контрастными и содержат максимальное количество рудных компонентов в начальный период таяния деятельного слоя, в котором весной происходит наибольшая концентрация рудного вещества. За летний период количество легкорастворимых сульфатных минералов в элювиально-делювиальных отложениях заметно уменьшается. К следующей весне легкорастворимые соединения в верхнем слое криолитозоны накапливаются вновь.
Для криолитозоны характерно существование двух разнонаправленных процессов при вымораживании – концентрирование солей в растворах и обессоливание льдов. В процессе замерзания воды происходит перераспределение солей – незамерзшая часть воды ими обогащается, а лед становится обедненным солями. Причем льдом захватываются труднорастворимые соединения (карбонаты), а в воде остаются легкорастворимые (хлориды, сульфаты). При неоднократном замораживании и размораживании могут образовываться соленые воды и рассолы хлоридного и сульфатного состава, а льды в значительной степени обессоливаются [1].
Деятельность микроорганизмов часто оказывается ведущей в разложении сульфидов, серы и органических веществ. В табл. 9 приведены примеры деятельности микроорганизмов.
Лабораторные и опытные работы на сульфидных месторождениях, на угольных пластах, содержащих в виде включений пирит, марказит или другие сульфиды, показали, что при воздействии на сульфиды Th. ferroxidans и Th. thiooxidans происходит значительная (примерно в 5-10 раз) интенсификация процессов окисления по сравнению со стерильными условиями: FeS04 → Fe(S04)3, FeS2 → FeS04 + H2 S04.
Микробиологические процессы сказываются не только на увеличении в водах содержания металлов, но и ведут к серьезным преобразованиям состава воды. Так, участие микроорганизмов в окислении сульфидов способствует формированию сульфатных вод, в процессах нитрификации – нитратных и нитритных вод, денитрификации – свободного азота, в процессах восстановления сульфатов – бессульфатных сероводородных вод.
Изучение форм и интенсивности развития микроорганизмов позволяет использовать микробиологические методы для изучения особенностей формирования состава вод сульфидных месторождений для оценки перспективности площадей в отношении рудоносности.
Таблица 9
|
|
|


