 |
Биологическая роль основных классов элементов в организме
|
|
|
|
Биологическая роль химических элементов в организме человека чрезвычайно разнообразна.
Главная функция макроэлементов состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава.
Микроэлементы, входя в состав ферментов, гормонов, витаминов, биологически активных веществ в качестве комплексообразователей или активаторов, участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсических веществ. Микроэлементы активно влияют на процессы кроветворения, окисления — восстановления, проницаемость сосудов и тканей. Макро- и микроэлементы: кальций, фосфор, фтор, иод, алюминий, кремний — определяют формирование костной и зубной тканей.
Имеются данные, что содержание некоторых элементов в организме человека меняется с возрастом. Так, содержание кадмия в почках и молибдена в печени к старости повышается. Максимальное содержание цинка наблюдается в период полового созревания, затем оно понижается и в старости доходит до минимума. Уменьшается с возрастом и содержание других микроэлементов, например ванадия и хрома.
Выявлено немало заболеваний, связанных с недостатком или избыточным накоплением различных микроэлементов. Дефицит фтора вызывает кариес зубов, дефицит иода— эндемический зоб, избыток молибдена — эндемическую подагру. Такого рода закономерности связаны с тем, что в организме человека поддерживается баланс оптимальных концентраций биогенных элементов — химический гомеостаз. Нарушение этого баланса вследствие недостатка или избытка элемента может приводить к различным заболеваниям.
Кроме шести основных макроэлементов — органогенов: углерода, водорода, азота, кислорода, серы и фосфора, из которых состоят углеводы, жиры, белки и нуклеиновые кислоты, для нормального питания человека и животных необходимы “неорганические” макроэлементы— кальций, хлор, магний, калий, натрий — и микроэлементы — медь, фтор, иод, железо, молибден, цинк, а также, возможно (для животных доказано), селен, мышьяк, хром, никель, кремний, олово, ванадий.
|
|
|
Анализ содержания и соотношения микроэлементов в организме человека находит применение и в судебно-медицинской экспертизе. Например, в случае алкогольного отравления под влиянием этилового спирта в печени повышается содержание кальция, а натрия и калия становится меньше. При этом в сердце и почках, наоборот, содержание кальция снижается.
Недостаток в пищевом рационе таких элементов, как железо, медь, фтор, цинк, иод, кальций, фосфор, магний и некоторых других, приводит к серьезным последствиям для здоровья человека.
Однако необходимо помнить, что для организма вреден не только недостаток, но и избыток биогенных элементов, так как при этом нарушается химический гомеостаз. Например, при поступлении избытка марганца с пищей в плазме повышается уровень меди (синергизм Mn и Cu), а в почках он снижается (антагонизм). Повышение содержания молибдена в продуктах питания приводит к увеличению количества меди в печени. Избыток цинка в пище вызывает угнетение активности железосодержащих ферментов (антагонизм Zn и Fe).
Минеральные компоненты, которые в ничтожно малых количествах являются жизненно необходимыми, при более высоких концентрациях становятся токсичными.
Однако существенное увеличение концентрации микроэлементов может привести к летальному исходу. Как правило, с увеличением заряда ядра атомов увеличивается токсичность элементов данной группы и уменьшается их содержание в организме. Уменьшение содержания, очевидно, связано с тем, что многие элементы длинных периодов из-за больших атомных и ионных радиусов, высокого заряда ядра, сложности электронных конфигураций, малой растворимости соединений плохо усваиваются живыми организмами.
|
|
|
Сходство и различие биологического действия связано с электронным строением атомов и ионов. Близкие значения атомных и ионных радиусов, энергий ионизации, координационных чисел, склонность к образованию связей с одними и теми же элементами в молекулах биолигандов обусловливает эффекты замещения элементов в биологических системах. Такое замещение ионов может происходить как с усилением (синергизм), так и с угнетением активности (антагонизм) замещаемого элемента.
Биологическая роль s-элементов IА-группы. Их применение в медицине
По содержанию в организме человека натрий (0,08 %) и калий (0,23 %) относятся к макроэлементам, а остальные щелочные металлы—литий (10-4%), рубидий (10~5%), цезий (Ю""4 %) —к микроэлементам. Щелочные металлы в виде различных соединений входят в состав тканей человека и животных. Натрий и калий относятся к жизненно необходимым элементам, постоянно содержатся в организме, участвуют в обмене веществ. Литий, рубидий и цезий также постоянно содержатся в организме, однако физиологическая и биохимическая роль их мало выяснена. Их можно отнести к примесным микроэлементам. В организме человека щелочные металлы находятся в виде катиона.
Литий
Содержание лития в организме человека около 70 мг (10 ммоль) — 10~4 % (см. табл.). Соединения лития у высших животных концентрируются в печени, почках, селезенке, легких, крови, молоке. Максимальное количество лития найдено в мышцах человека. Биологическая роль лития как микроэлемента пока до конца не выяснена.
Доказано, что на уровне клеточных мембран ионы лития (при достаточной концентрации) конкурируют с ионами натрия при проникновении в клетки. Очевидно, замещение ионов натрия в клетках ионами лития связано с большей ковалентностью соединений лития, вследствие чего они лучше растворяются в фосфолипидах.
Установлено, что некоторые соединения лития оказывают положительное влияние на больных маниакальной депрессией. Всасываясь из желудочно-кишечного тракта, ионы лития накапливаются в крови. Когда концентрация ионов лития достигает 0,6 ммоль/л и выше, происходит снижение эмоциональной напряженности и ослабление маниакального возбуждения. Вместе с тем содержание ионов лития в плазме крови нужно строго контролировать. В тех случаях, когда концентрация ионов лития превышает 1,6 ммоль/л, возможны отрицательные явления.
|
|
|
Натрий
Содержание натрия в организме человека массой 70 кг составляет около 60 г (2610 ммоль)—0,08% (см. табл. 5.3). Из этого количества 44 % натрия находится во внеклеточной жидкости и 9 % — во внутриклеточной. Остальное количество натрия находится в костной ткани, являющейся местом депонирования иона Nа+ в организме. Около 40 % натрия, содержащегося в костной ткани, участвует в обменных процессах и благодаря этому скелет является либо донором, либо акцептором ионов натрия, что способствует поддержанию постоянства концентрации ионов натрия во внеклеточной жидкости.
Натрий является основным внеклеточным ионом. В организме человека находится натрий в виде его растворимых солей, главным образом хлорида, фосфата и водородкарбоната. Натрий распределен по всему организму: в сыворотке крови, спинно-мозговой жидкости, глазной жидкости, пищеварительных соках, желчи, почках, коже, костной ткани, легких, мозге.
Ионы натрия играют важную роль в обеспечении постоянства внутренней среды человеческого организма, участвуют в поддержании постоянного осмотического давления биожидкости {осмотического гомеостаза). В виде противо-ионов в соединениях с фосфорной кислотой (фосфатная буферная система Nа2НРO4 + NаН2PO4) и органическими кислотами натрий обеспечивает кислотно-основное равновесие организма. Ионы натрия участвуют в регуляции водного обмена и влияют на работу ферментов. Вместе с ионами калия, магния, кальция, хлора ион натрия участвует в передаче нервных импульсов через мембраны нервных клеток и поддерживает нормальную возбудимость мышечных клеток. При изменении содержания натрия в организме происходят нарушения функций нервной, сердечно-сосудистой и других систем, гладких и скелетных мышц. Натрий хлорид NаС1 служит основным источником соляной кислоты для желудочного сока.
|
|
|
В организм человека натрий поступает в основном в виде поваренной соли. Истинная ежедневная потребность организма в натрии составляет 1 г, хотя среднее потребление этого элемента достигает 4—7г. Непрерывное избыточное потребление NаС1 способствует появлению гипертонии. В организме здорового человека поддерживается равновесие между количеством потребляемого и выделяемого натрия. Около 90 % потребляемого натрия выводится с мочой, а остальные — с потом и калом.
Многие важные биологические процессы осуществляются только при условии различного ионного и молекулярного состава внутри клеток и во внеклеточной жидкости. Так, концентрация ионов Nа+ внутри клетки примерно в 15 раз меньше, чем во внеклеточной жидкости. Наоборот, концентрация ионов калия приблизительно в 35 раз выше внутри клетки, чем вне ее.
Чтобы поддержать такое распределение, ионы К+ должны постоянно перемещаться из внешней среды, где их концентрация ниже, внутрь клетки, т.е. в среду с более высокой концентрацией ионов К+. Напротив, ионы натрия из клетки, внутри которой их концентрация меньше, перемещаются во внеклеточную жидкость с более высокой концентрацией ионов Nа+.
Этот процесс приводит к повышению энергии Гиббса, а следовательно, в соответствии со 2-м законом термодинамики, самопроизвольно протекать не может. Нормальное распределение ионов обеспечивается работой натрий-калиевых насосов. Эти насосы, обеспечивающие перенос ионов через плазматическую мембрану против градиента концентрации и поддерживающие этот градиент, требуют большой затраты энергии.
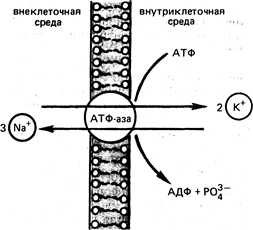 Рис. Схема действия Na/K-АТФазы
Рис. Схема действия Na/K-АТФазы
Поэтому, как и многие другие биохимические процессы, перенос ионов Nа+ и К+ через клеточные мембраны сопряжен с экзоэргонической реакцией гидролиза АТФ.
Натрий-калиевый градиент обусловливает возникновение разности потенциалов на клеточной мембране. За счет энергии гидролиза одной молекулы АТФ три иона Nа+ выводятся из клетки, а два иона К+ поступают внутрь клетки. Такой дисбаланс электрических зарядов и служит причиной возникновения разности потенциалов на плазматической мембране, в частности нервных волокон. При этом внутренняя сторона мембраны заряжена отрицательно по отношению к внешней поверхности мембраны.
Изотонический раствор NаС1 (0,9 %) для инъекций вводят подкожно, внутривенно и в клизмах при обезвоживании организма и при интоксикациях, а также применяют для промывания ран, глаз, слизистой оболочки носа, а также для растворения различных лекарственных препаратов.
|
|
|
Гипертонические растворы NаС1 (3—5—10%) применяют наружно в виде компрессов я примочек при лечении гнойных ран.. Применение таких компрессов способствует по законам осмоса отделению гноя из ран и плазмолизу бактерий (антимикробное действие). 2—5 %-ный раствор NаС1 назначают внутрь для промывания желудка при отравлении AgNОз, который при этом превращается в малорастворимый и нетоксичный серебра хлорид:
Аg+ (р) +С1- (р) =АgС1 (т)
Натрий водородкарбонат (натрий гидрокарбонат, сода двууглекислая, сода питьевая) NаНСОз используют при различных заболеваниях, сопровождающихся повышенной кислотностью—ацидозом (диабет и др.). Механизм снижения кислотности заключается во взаимодействии NаНСОз с кислыми продуктами. При этом образуются натриевые соли органических кислот, которые в значительной мере выводятся с мочой, и углерод диоксид, покидающий организм с выдыхаемым воздухом:
NаНСОз (р) + КСООН (р) -> КСООNа) (р) + Н2O (ж) + + СO2 (г)
Используют NаНСОз и при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки. При приеме NаНСОз протекает реакция нейтрализации избыточной соляной кислоты:
NаНСОз (р) + НС1 (р) = NаС1 (р) + H2O (ж) + СO2 (г)
Следует иметь в виду, что применение NаНСОз вызывает ряд побочных эффектов. Выделяющийся при реакции углерод диоксид раздражает рецепторы слизистой оболочки желудка и вызывает вторичное усиление секреции, кроме того, он может способствовать перфорации стенки желудка при язвенной болезни.
Слишком большая доза NаНСОз в результате гидролиза приводит к алкалозу, что не менее вредно, чем ацидоз.
Растворы натрия водородкарбоната применяют в виде полосканий, промываний при воспалительных заболеваниях глаз, слизистых оболочек верхних дыхательных путей. Действие NаНСОз в качестве антисептического средства основано на том, что в результате гидролиза, протекающего в очень незначительной степени, водный раствор NаНСОз проявляет слабощелочные свойства:
NаНСОз + Н2O Û NаОН + Н2СОз
При воздействии щелочей на микробные клетки происходит осаждение клеточных белков и вследствие этого гибель микроорганизмов.
Натрий сульфат (глауберова соль) Nа2SO4-10Н20 применяют в качестве слабительного средства. Эта соль медленно всасывается из кишечника, что приводит к поддержанию повышенного осмотического давления в полости кишечника в течение длительного времени. В результате осмоса происходит накопление воды в кишечнике, содержимое его разжижается, сокращения кишечника усиливаются и каловые массы быстрее выводятся.
Натрий тетраборат Nа2В4O7×10Н20 применяют наружно как антисептическое средство для полосканий, спринцеваний, смазываний. Антисептическое действие тетрабората аналогично NаНСОз и связано с щелочной реакцией среды водного раствора этой соли вследствие ее гидролиза, а также с образованием борной кислоты:
Натрий гидроксид в виде 10 %-ного раствора входит в состав силамина, применяемого в ортопедической практике для отливки огнеупорных моделей при изготовлении цельнолитых протезов из кобальтохромового сплава.
Радиоактивный изотоп Na в качестве метки применяют для определения скорости кровотока, кроме того, он используется для лечения некоторых форм лейкемии.
Калий
Содержание калия в организме человека массой 70 кг составляет примерно 160 г (4090 ммоль)—0,23%. Калий является основным внутриклеточным катионом.
Из общего количества калия, содержащегося в организме, 98 % находится внутри клеток и лишь около 2 % — во внеклеточной жидкости. Калий распространен по всему организму. Его топография: печень, почки, сердце, костная ткань, мышцы, кровь, мозг и т.д.. Ионы калия К+ играют важную роль в физиологических процессах — сокращении мышц, нормальном функционировании сердца, проведении нервных импульсов, обменных реакциях. Ионы К+ являются важными активаторами ферментов, находящихся внутри клетки.
Калий, как уже отмечалось выше, в большинстве случаев является антагонистом натрия.
Ионы Nа+ и К+ принимают участие в биокатализе, образуя смешанные комплексы типа фермент — катион — субстрат.
Подтверждением того, что комплексообразование калия с ферментами и субстратами играет важную роль в транспорте ионов, является образование комплексов этих катионов с антибиотиком валиномицином. Уже давно известно, что антибиотики, подобные валиномицину, вызывают транспорт ионов калия в митохондрии. Валиномицин образует прочный комплекс с ионами калия, в то время как ион натрия связывается этим антибиотиком в очень незначительной степени. Вследствие этого валиномицин можно рассматривать как биологическую модель переносчика ионов калия через плазматические мембраны в клетку.
Взрослый человек обычно потребляет с пищей 2—3 г калия в сутки. Концентрация ионов калия К4' во внеклеточных жидкостях, включая плазму, составляет в норме 3,5—5,5 ммоль/л, а концентрация внутриклеточного калия—115—125 ммоль/л.
При калиевом истощении применяют калий хлорид КС1 4—5 раз в день по 1 г.
|
|
|


