 |
Биологическая роль d-элементов семейства железа. Применение их соединений в медицине
|
|
|
|
Из трех металлов этой группы железо и кобальт являются важнейшими биогенными элементами и относятся к металлам жизни.
Железо. В организме человека содержится 5 г железа. Большая часть его сосредоточена в гемоглобине крови (около 70%). Железо входит также в состав ферментов, например цитохромов, каталазы, пероксидазы и др. В связанной форме железо находится в некоторых белках, которые выполняют в организме роль переносчиков железа.
Одним из наиболее важных внутрикомплексных соединений, которые создала природа, является гемоглобин. Это сложный по составу белок, содержащий и 'небелковую (простетическую) группу — гем, на долю которой приходится около 4 % массы гемоглобина.
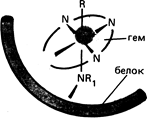
Простетическая группа представляет собой бионеорганический комплекс железа (II) с полициклическим органическим веществом — порфирином. Эта группа и носит название гем (от греч. гема—кровь). Гем имеет плоскостное строение.
В геме атом железа образует четыре связи с азотом донорных групп в плоскости порфиринового кольца. Пятую связь железо гемоглобина образует с азотом имидазольной группы гистидина — аминокислотного остатка глобина.
Имидазольная группа, согласно протолитической теории, является основанием. При рН, близких к нейтральным значениям — 7, имидазольное кольцо способно присоединить протон из раствора и образовать так называемый ион имидазолия. Считают, что положительный заряд этого иона создает электростатическое поле, которое и препятствует Fе2+ отдавать электроны. Это один из примеров, когда лиганд благодаря своим специфическим свойствам стабилизирует степень окисления металла комплексообразователя. Доказано, что если произойдет замена гистидина на лиганд, не обладающий электростатическим эффектом, то железо в гем-группе может окислиться до Fe3+. В таком состоянии гемоглобин не способен присоединять кислород, т. е. нарушается его функция и организм заболевает.
|
|
|
Железо в геме имеет и шестую орбиталь, которая в гемоглобине используется в процессе связывания кислорода. Эта же орбиталь участвует в образовании связи с углеродом монооксидом. Доказано, что пятая и шестая связи перпендикулярны к плоскости порфиринового кольца, что показано на схеме.
Физиологическая функция гемоглобина заключается в способности обратимо связывать кислород и переносить его от легких к тканям. Если гемоглобин условно обозначить НЬ-Fе2+, то реакцию обратимого присоединения кислорода можно записать так:
[НЬ.Fе2+] + O2 = [НFе2+ O2]
дезоксигемоглобин оксигемоглобин
Гемоглобин, присоединивший кислород, называется оксигемоглобином, а без кислорода — дезоксигемоглобином.
Дезоксигемоглобин имеет такую структуру, которая характеризуется наименьшим сродством к кислороду. В ней атомы железа гема выступают над плоскостью порфиринового кольца. В процессе присоединения уже первой молекулы 02 изменяются размеры так называемого гемового кармана (в НЬ они меньше, чем в НЬ-О2 ). В оксигемоглобине атом железа находится в плоскости порфиринового кольца. Эти изменения индуцируют такие же изменения и в других гемах молекулы. В результате возникает структура, которая увеличивает сродство к кислороду, и гемоглобин постепенно насыщается кислородом.
Гемоглобин взаимодействует также с углеродом монооксидом, который в быту известен как угарный газ. При этом образуется макроциклический комплекс с железом — карбонилгемоглобин..
Константа устойчивости этого комплекса приблизительно в 200 раз больше, чем комплекса железа с кислородом в геме. Поэтому при вдыхании углерода монооксида большая часть гемоглобина переходит в карбонилгемоглобин, что и нарушает перенос кислорода от легких к тканям и вызывает отравление организма. При значительном увеличении парциального давления кислорода равновесие реакции может сместиться в сторону разрушения НbFе-СО и большего образования оксигемоглобина НbFе-O2.
|
|
|
Структуру, подобную гемоглобину, имеет и миоглобин (МЬ). Он обратимо связывает кислород в мышцах, по механизму действия сходен с гемоглобином и относится к гемосодержащим белкам.
Существует большая группа железосодержащих ферментов, которые катализируют процесс переноса электронов в митохондриях, это так называемые цитохромы (ЦХ). Всего известно около 50 цитохромов. Наиболее изученным считается цитохром С. Доказано, что перенос электронов в окислительно-восстановительной цепи с участием этого фермента осуществляется за счет изменения состояния железа
ЦХ • Fе2+ + е- ^ = ЦХ • Fе3+
Группы ферментов, катализирующих реакции окисления водородпероксидом, называются каталазами и пероксидазами. Они также имеют в своей структуре гем, в центре которого находится железо со степенью окисления +3. Механизм действия каталазы до конца не ясен, но доказано, что Fе3+ не восстанавливается. Каталаза ускоряет разложение водородпероксида, который образуется в реакциях метаболизма:
Н2O2 + Н2O2 = 2Н2O + O2
В этой реакции одна молекула Н2O2 является окислителем, другая — восстановителем. Реакция идет с большой скоростью, одна молекула каталазы может разложить 44 000 молекул H2O2 в сек.
Фермент пероксидаза ускоряет реакции окисления органических веществ водородпероксидом.
В органах и тканях имеется так называемое депонированное (запасенное) железо, которое используется, если возникает дефицит железа. Депонируется оно с помощью белка — ферритина, который представляет собой биокластер с молекулярной массой 460000.
В организме железо может транспортироваться в виде аминокислотных комплексов, которые образуются за счет координационной связи железа с азотом пептидных групп. Образование таких бионеорганических комплексов делает возможным прохождение ионов через клеточные мембраны. Как известно, липидный слой оболочки клетки затрудняет прохождение ионов металлов в виде акваионов. А если ион металла находится в окружении органических лигандов, то он достаточно легко проходит через клеточную мембрану.
|
|
|
Железо также транспортируется в виде железосодержащих белков, например трансферринов. В механизме действия трансферрина многое остается дискуссионным, но доказано, что трансферрин отдает железо в виде Fез+. Функция трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых осуществляется синтез гемоглобина.
Кобальт в роли микроэлемента выполняет разнообразные функции. В организме он представлен в виде витамина B12. По составу витамин —бионеорганическое комплексное соединение порфиринового ряда, в котором комплексообразователем является Со3+. В молекуле В12 кобальт имеет координационное число, равное 6, что соответствует 5р3d2 — гибридизации атома. В структуре В12 кобальт занимает такое же положение, какое занимает железо в гемоглобине.
Существуют ферментативные системы, в составе которых действует не свободный витамин B12, а так называемые В12-коферменты (кофакторы). Кофактор — активная и легко отделяемая часть фермента. Оставшаяся неактивная белковая часть называется апоферментом. В роли кофермента B12 выполняет две основные функции: 1) роль переносчика метильных СНз-групп (реакции метилирования); 2) участвует в реакциях переноса ионов водорода и сам при этом восстанавливается.
Выполняя эти функции, кобальт влияет на углеводный, минеральный, белковый и жировой обмен, а также принимает участие в процессе кроветворения.
Никель по сравнению с железом и кобальтом играет более скромную роль в организме. Известно, что по мере спаривания электронов на n-подуровне растет устойчивость (п— 1) d-слоя и уменьшается химическая активность. Можно предположить, что именно эта большая химическая инертность обусловила меньшее содержание никеля в организме человека (в 10 раз меньше, чем Со) и меньшее его участие в биохимических процессах. Однако имеются данные, что никель, так же как и кобальт, участвует в кроветворении, влияет на углеводный обмен.
|
|
|
Недостаток железа и кобальта в организме приводит к нарушению синтеза гемоглобина. Это, в свою очередь, вызывает заболевание крови, связанное с дефицитом железа, которое называется анемией.
Для лечения анемии используют соли двухвалентного железа хлорид и сульфат. В лечебных целях применяют препараты железа, в состав которых вводят еще медь и кобальт. Эффективным средством для лечения анемии являются феррамид и коамид, которые являются соответственно бионеорганическими комплексами железа и кобальта с никотиновой кислотой.
В силу окислительных свойств, которые проявляет раствор FеСlз, его используют в медицинской практике как дезинфицирующее и кровоостанавливающее средство.
Витамин В12 применяют при лечении анемии, нервных заболеваний. В эксперименте доказано, что кобальт в виде простых растворимых солей значительно хуже всасывается и оказывает меньший лечебный эффект, чем кобальт в окружении органических лигандов в витамине В12.
Нашел применение изотоп радиоактивного кобальта для лечения злокачественных опухолей.
Таким образом, железо и кобальт — жизненно необходимые элементы, входят в состав различных бионеорганических соединений. Никель — примесный токсичный элемент.
|
|
|


