 |
Основные типы диаграмм состояния
|
|
|
|
Кристаллизация металлов и сплавов.
Металлы и металлические сплавы получают чаще всего путем кристаллизации из жидкого состояния. Методом термического анализа можно построить кривые нагрева или охлаждения металла.
В огнеупорный тигель, содержащий расплавленный металл, погружают термопару, концы которой подсоединяют к гальванометру.
Температуру фиксируют через равные промежутки времени.
Схема термического анализа.


Полученные кривые неодинаковы для аморфного и кристаллического тел. Затвердевание аморфного тела происходит постепенно без явных границ между твердыми и жидкими состояниями.
При превращении тела из жидкого в твердого состояния при ts (t кристалл.) появляется горизонтальная площадка, которая объясняется выделяющейся скрытой теплотой кристаллизации, которая компенсирует отвод тепла.
При очень медленном охлаждении в системе идет равновесный процесс кристаллизации и при ts соответствует равновесной (tр)
При быстром охлаждении температура кристаллизации сдвигается до температуры переохлаждения tп. Разность температур ts – tn – степень переохлаждения.

Сначала процесс кристаллизации протекает быстро, но при взаимном столкновении рост кристаллизации замедляется.
Пока кристаллы окружены жидкостью, они имеют правильную форму. Однако, при столкновении и нарастании их правильная форма нарушается.
При затвердевании границы принимают округлую форму и такие кристаллы называют зернами или кристоллитами.

Процесс кристаллизации металла из жидкости состоит из двух протекающих стадий: образование зародышей (центров крист.) и роста кристаллов.
Центрами крист. являются либо затвердевшие мельчайшие частицы металла, либо частицы примеси.
|
|
|
При небольших степенях переохлаждения, когда скорость роста зародыша велика, а скорость образования зародышей мала, формируются крупнозернистые структуры.
При увел. переохл. скорость образования зародышей увеличивается более интенсивно, чем скорость их роста и образуются более мелкие кристаллы в металле.
При быстром росте кристаллов по 3 направлениям образуются кристаллы древообразной формы, которая называются дендритами. Такая структура характерна для металлических слитков.
Основные понятия в теории сплавов.
Сплавами называются сложные вещества, полученные сплавлением 2-х и более простых веществ.
Метод получения плавления чистых веществ: диффузия, методы порошковой металлургии и т.д.
Преимущества: обладают более высокими механическими свойствами и эксплуатационными характеристиками по сравнению с чистыми металлами.
К основным понятиям в теории сплавов относятся компонент, система, фаза.
Компоненты – вещества (элементы), которые применяют для изучения сплавов. Компонент, преобладающий в сплаве количественно, называется основным.
Совокупность компонентов сплава называется системой.
Фазой называется однородная часть сплава, отделенная от других частей поверхностью раздела, при переходе через которую химический состав и структура материала изменяется скачком.
Взаимодействие компонентов при образовании сплавов.
В процессе кристаллизации металлов из жидкого состояния могут образоваться следующие сплавы:
1. механические смеси образуются, когда из жидкого расплава выпадают кристаллы составляющих его компонентов.
Компоненты не склонны к взаимному растворению и не взаимодействуют друг с другом, кроме того они имеют различные кристаллические решетки.
2. твердые растворы.
В ТР сохраняется решетка одного из компонентов, а второй компонент, утратив свой кристаллическое строение распределяется в первом в виде отдельных атомов.
|
|
|
1-ый компонент – растворитель
2-ой компонент – растворимый
По типу расположения атомов растворяемого элемента твердые растворы делятся на 2 группы: замещения и внедрения.
В твердых растворах замещения атомы компонента В замещают атомы компонента А (основной металл) в узлах кристаллической решетки.

В данном случае мы имеем твердый раствор с ограниченной растворимостью.
Если металлы имеют сходные свойства и одинаковый тип кристаллической решетки с близкими параметрами, то они могут неограниченно растворяться друг в друге, т.е. атомы сорта А могут на 100% заменить атомы сорта В, и наоборот.
В таких случаях говорят, что компоненты неограниченно растворимы друг в друге.
В твердом растворе внедрения атомы растворенного вещества В располагаются в промежутках кристаллической решетки между атомами растворителя А.
Чаще всего это имеет место, когда в металле растворяются неметаллические элементы с малым размером радиуса (H, C, N, B и т.д.)
Основные типы диаграмм состояния двухкомпонентных сплавов состояния.
Диаграмма состояния – графическое изображение равновесного превращения, протекающего в сплаве в координатах температура – концентрация.
Диаграммы состояния строят экспериментальным путем при помощи термического анализа.
Отбирают несколько сплавов с различным содержанием компонентов и строят кривые их охлаждения. По остановкам и перегибах на кривых, которые соответствуют критическим точкам определяют температуру начала и конца кристаллизации.
Чистые вещества имеют 1 критическую точку, а сплавы 2, так как температура начала кристаллизации у них разная, а конца одинаковая.
Критические точки переносятся на диаграмму в координатах температура – состав.
После кристаллизации компоненты сплава образуют механическую смесь в виде кристаллизации отдельных компонентов, то ДС имеет следующий вид.
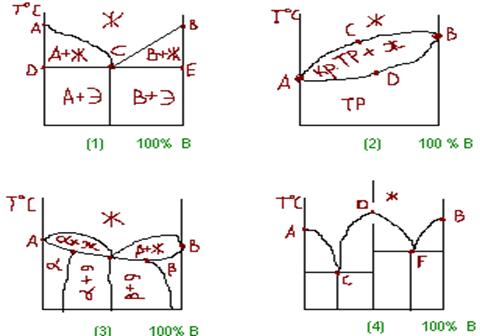
Линия АСВ, которая отвечает началу кристаллизации из жидкого расплава, называется линией ликвидус.
Линия DCE отвечает концу кристаллизации и называется линией солидус.
Ниже ее сплав находится в твердом состоянии.
В промежутках сплавы находятся как в жидком так и в твердом виде.
|
|
|
Сплав, соответствующий точке С, называется эфтектическим.
Превращение жидкости с образованием мех. …
Эфтектика имеет самую низкую температуру плавления.
После кристаллизации сплавы могут образовать твердые растворы.
При неограниченной растворимости компонентов друг в друге в твердом состоянии, диаграмма имеет следующий вид (2).
Линия АСВ – ликвидус, ADB – солидус.
Ниже ее твердый раствор.
Между ними кристаллы ТР и жидкости.
При ограниченной растворимости компонентов в твердом состоянии, диаграмма может иметь следующий вид (3).
АСВ – ликвидус, ADC – солидус.
α – ТР замещения компонента А в компоненте В
β – ТР компонента В в компоненте А.
На DCE в т. С образуется эфтектика из крист. в ТВ.
При образовании в твердое состояние химического соединения, которое имеет решетку, отличную от решеток компонентов, диаграмма состояния имеет вид (4).
Т. D соответствует химическому соединению.
Линия DE имеет диаграмму на 2 простые эфтектика.
В твердом состоянии компоненты А и В не растворимы друг в друге и с хим. соед.
САМОСТОЯТЕЛЬНО обозначить на диаграмме линии ликвидус, солидус, а также области диаграммы состояния.
|
|
|


