 |
1. Биологическая роль и структура белков.
|
|
|
|
1. Биологическая роль и структура белков.
Биологическая роль белков:
1. каталитическая (выполняют ферменты);
2. структурная, т. е. белки являются основным компонентом клеточных структур;
3. регуляторная (выполняют белки-гормоны);
4. рецепторная, т. е. рецепторы клеточных мембран имеют белковую природу;
5. транспортная – белки участвуют в транспорте липидов, токсических веществ, кислорода и т. д.;
6. опорная – выполняет белок коллаген;
7. энергетическая. Заключается в том, что при окислении 1г белка выделяется 4, 1ккал энергии;
8. сократительная – её выполняют белки актин и миозин;
9. генно-регуляторная – её выполняют белки гистоны, участвуя в регуляции репликации;
10. имуннологическая – её выполняют белки антитела;
11. гемостатическая – участвуют в свёртывании крови, препятствуют кровотечению;
12. антитоксическая, т. е. белки связывают многие токсические вещества (особенно соли тяжёлых металлов) и препятствуют развитию интоксикации в организме.
Структура белка.
Последовательность расположения аминокислотных остатков в полипептидной цепи белковой молекулы получила название первичной структуры белка. Первичная структура белка, помимо большого числа пептидных связей, обычно содержит также небольшое число дисульфидных (-S-S-) связей. Пространственная конфигурация полипептидной цепи, точнее тип полипептидной спирали, определяет вторичную структуру белка, она представлена в основном α -спиралью, которая фиксирована водородными связями. Третичная структура -полипептидная цепь, свернутая целиком или частично в спираль, расположена или упакована в пространстве (в глобуле). Известная стабильность третичной структуры белка обеспечивается за счет водородных связей, межмолекулярных ван-дер-ваальсовых сил, электростатического взаимодействия заряженных групп и т д.
|
|
|
Четвертичная структура белка — структура, состоящая из определенного числа полипептидных цепей, занимающих строго фиксированное положение относительно друг друга (гемоглобин).
2. Переваривание белков в желудке: ферменты, система их активации, оптимумph, специфичность, продукты переваривания.
Расщепление белков до аминокислот начинается в желудке, продолжается в двенадцатиперстной кишке и заканчивается в тонком кишечнике.
Протеолитические ферменты подразделяют по особенности их действия на экзопептидазы, отщепляющие концевые аминокислоты, и эндопептидазы, действующие на внутренние пептидные связи.
В желудке пища подвергается воздействию желудочного сока, включающего соляную кислоту и ферменты. К ферментам желудка относятся две группы протеаз с разным оптимумом рН, это пепсин и гастриксин.
Пепсин
Оптимум рН для работы пепсина 1, 5-2, 0.
Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр " прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформацияпепсиногена изменяется таким образом, что " раскрывается" активный центр фермента, который отщепляет остаточный пептид (N-концевой фрагмент), т. е. происходит аутокатализ. В результате образуется активный пепсин, активирующий и другие молекулы пепсиногена.
Превращение пепсиногена в пепсин

| Связи, расщепляемые пепсином
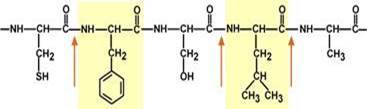 Пепсин обладает невысокой специфичностью,
· в основном он гидролизует пептидные связи, образованные аминогруппами ароматическихаминокислот (тирозина, фенилаланина, триптофана),
· меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т. д. Пепсин обладает невысокой специфичностью,
· в основном он гидролизует пептидные связи, образованные аминогруппами ароматическихаминокислот (тирозина, фенилаланина, триптофана),
· меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т. д.
|
|
|
|
Гастриксин
Гастриксин по своим функциям близок к пепсину, его количество в желудочном соке составляет 20-50% от количества пепсина. Синтезируется главными клетками желудка в виде прогастриксина (профермент) и активируется соляной кислотой. Оптимум рН гастриксина соответствует 3, 2-3, 5 и значение этот фермент имеет при питании молочно-растительной пищей, слабее стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. Гастриксин является эндопептидазой и гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот.
|
|
|


