 |
Растворимость твердых веществ
|
|
|
|
Растворимость зависит от природы растворяемого вещества и температуры. Давление влияет незначительно. Лучше растворяются вещества, которые взаимодействуют с водой, образуя гидраты. Температура влияет на растворимость различно:
1) при изменении температуры от 0 до 100 0С растворимость KNO3 увеличивается в 19 раз, а NaCl на 10 %.
2) Растворимость CаSO4 ∙2H2O и Ca(OH)2 с повышением температуры падает.
Взаимная растворимость жидкостей
А) Полярные жидкости хорошо растворяются в полярных, а неполярные в неполярных растворителях. Взаимная растворимость изменяется в широких пределах: в любых соотношениях смешиваются полярные жидкости ацетон и вода. Но жидкие углеводороды (октан, декан и др.) неполярны и практически не растворяются в воде.
Б) При повышении температуры растворимость ограниченно растворимых друг в друге жидкостей увеличивается и при определенной температуре (критической t0 растворения) они становятся неограниченно растворенными друг в друге.
В) Взаимная растворимость жидкостей не зависит от давления.
Г) Температура кипения смесей с ограниченной растворимостью ниже, чем температура кипения каждого компонента. Такие смеси называются азеотропными (нераздельно кипящими). Например, фенол – вода, t0 кипения фенола -181,4 0С, а смеси 98,6 0С при полном испарении одного из соединений температура кипения резко возрастает. Это свойство азеотропных смесей используется для очистки промышленных стоков от органических примесей (фенола, органических кислот) методом перегонки с водяным паром.
Свойства растворов
1. Закон Рауля (1887г.).
Относительное понижение давления насыщенного пара над раствором равно отношению числа молей растворенного вещества к сумме молей растворителя и растворенного вещества
|
|
|

р0 – давление насыщенного пара чистого растворителя;
р- давление пара над раствором;
n – число молей растворенного вещества;
N - число молей растворителя.
Понижение давления насыщенного пара над раствором вызывает изменения температуры кипения и замерзания раствора по сравнению с чистым растворителем. Растворы кипят при более высокой температуре.
 ,
,
∆Тк - повышение температуры кипения, 0С;
Е – эбуллиоскопическая константа растворителя (для воды равна 0,52 0С);
M – моляльная концентрация раствора.
Замерзают растворы при более низкой температуре, чем у чистого растворителя.
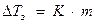 ,
,
К – криоскопическая константа (для Н2О К = 1,86 0С).
Поэтому морская вода замерзает при 19 0С.
Самопроизвольный переход молекул растворителя через полупроницаемую мембрану против градиента концентрации называется осмосом.
Гидростатическое давление, оказываемое молекулами растворителя на мембрану, называется осмотическим.
Величина осмотического давления для разбавленных растворов не зависит от химической природы растворителя и растворенного вещества, а определяется разностью концентраций растворов, разделенных мембраной. Чем больше эта разность, тем больше осмотическое давление.
 , где
, где
П – осмотическое давление, Па;
С- молярная концентрация моль/м3;
R - газовая постоянная = 8,31 Дж/моль∙К;
Т- термодинамическая температура раствора, К.
Вышеуказанные зависимости справедливы для растворов неэлектролитов, так как в электролитах (вследствие их диссоциации) присутствуют большее число частиц. Поэтому в вышеуказанные уравнения для электролитов вводится поправочный множитель (i) - изотонический коэффициент. Он рассчитывается по формуле
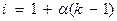 (для слабых электролитов)
(для слабых электролитов)
α – степень диссоциации;
κ – количество ионов образующихся при диссоциации молекул.
|
|
|
|
|
|


