 |
Механизм протекания реакций гидролиза
|
|
|
|
1. Соль образована одноосновной кислотой и одновалентным металлом.
СН3СООNa + Н2О → СН3СООН + NaОН
СН3СОО- + Н2О → СН3СООН + ОН-
Из уравнения видно, что гидролизу подвергается анион соли и освобождается ОН-. Но поскольку ионное произведение воды [H+] [OH-] – величина постоянная, то при накоплении ионов ОН- концентрация ионов Н+ уменьшается. Следовательно: растворы солей, образованные слабой кислотой и сильным основанием имеют щелочную реакцию.
2. Аналогично в случае соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли и освобождаются ионы водорода.
NH4Cl + H2O ↔ NH4OH + HCl
NH4+ + H2O ↔ NH4OH + H+
В этом случае реакция среды кислая.
3. Соль образована слабой многоосновной кислотой или слабым основанием многовалентного металла. Гидролиз таких солей протекает ступенчато.
1) Na2CO3 + H2O ↔ NaHCO3 + NaOH
CO3 2- + H2O ↔ HCO3- + OH –
2) NaHCO3 + H2O → NaOH + H2CO3
HCO3- + H2O →H2CO3 + OH –
Аналогично для солей образованных слабым основанием и сильной кислотой

Для соли слабой кислоты и слабого основания

Запишем уравнение гидролиза в общем виде:
МА + Н2О ↔ НА + МОН
НА – кислота
МОН – основание
МА – соль.
Этому равновесию отвечает константа:

[Н2О] – величина постоянная. Тогда

К· [Н2О] - Кг (константа гидролиза), таким образом

Для случая соли слабой кислоты и сильного основания

Отсюда следует, что Кг обратно пропорциональна Ккислоты, чем слабее кислота, тем сильнее гидролизуются ее соли.
При гидролизе по первой ступени образуется ион НСО3-. Его диссоциация характеризуется второй константой диссоциации угольной кислоты. Во второй ступени образуется Н2СО3, его характеризует первая константа диссоциации.
Поэтому,
|
|
|
 ;
;
 ;
;
так как К1 > К2, то КГ1 > КГ2.
Следовательно, гидролиз по первой степени всегда протекает в большей степени, чем по второй.
Аналогично проходит гидролиз соли образованный слабым основанием многовалентного металла.
CuCl2 + H2O ↔ CuOHCl +HCl
Cu2+ + H2O ↔ CuOH+ + H+
В ничтожно малой степени:
CuOHCl + H2O → Сu(OH)2 + HCl
Cu2+ + H2O → Сu(OH)2 + H+
Особенно глубоко протекает гидролиз солей образованных слабой кислотой и слабым основанием.
Al(CH3COO)3 + H2O ↔ Al(OH)(CH3COO)2 + CH3COOH
Al(OH)(CH3COO)2 + H2O ↔ Al(OH)2(CH3COO) + CH3COOH
Гидролиз катиона:
Аl3+ + H2O ↔ AlOH 2+ + H+
Гидролиз аниона:
СН3СОО- + Н2О ↔ СН3СООН + ОН-
При гидролизе катиона образуется Н+, при гидролизе аниона образуется ОН-. Реакция среды в этом случае зависит от отношения констант диссоциации. Если кислота и основание, образующие соль, не только слабые электролиты, но и малорастворимы или неустойчивы, то гидролиз часто протекает необратимо.
Гидролиз хлора
При растворении хлора в воде происходит его гидролиз по следующему уравнению.
Сl2 + H2О ↔ НОСl + HCl
Равновесие сильно смещено влево. При соединении хлора с водой образуются незначительные количества соляной и хлорноватистой кислоты.
Но равновесие хлора с водой можно сместить вправо добавлением щелочи.
Cl2 + 2KOH ↔KCl + KOCl + H2O
В растворе хлорной воды в виде ионов находится только соляная кислота, так как хлорноватистая – слабая, поэтому присутствие сильной кислоты подавляет ее действие почти нацело.
Сl2 + HOH ↔ H+ + Cl- + HOCl
Константа гидролиза будет равна
 = Кгидр = 4,5·10-4
= Кгидр = 4,5·10-4
Гидролиз хлорамина

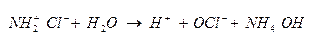
Буферные растворы
Буферными растворами называются растворы, рН которых не изменяется при прибавлении небольшого количества сильной кислоты или щелочи.
Основные виды буферов:
1. Слабая кислота и ее соль (ацетатная СН3СООН и СН3 СООNa), (карбонатная Н2СО3 и NaHCO3).
Пример.
Н2СО3 ↔ Н+ + НСО3-
NaHCO3 ↔ Na+ + HCO3-
NaHCO3 – сильный электролит.
Диссоциация Н2СО3 – подавлена вследствие наличия в воде НСО3- из соли. При введении в такой раствор кислоты ионы Н+ будут взаимодействовать с ионами НСО3- , образуя компонент буфера – Н2СО3
|
|
|
Н+ + НСО3- → Н2СО3
Если добавить щелочь, то введенные ионы ОН- взаимодействуют с малым количеством ионов Н+ из Н2СО3
Н++ ОН- → Н2О
Запишем выражение константы диссоциации Н2СО3
 , так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
, так как диссоциация невелика, можно считать [Н2СО3] равной общей концентрации кислоты Скисл.
[HCO3-] =С соли.
Получаем 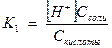 , откуда [H+] =
, откуда [H+] =  .
.
Так как [H+], а следовательно и рН зависит не от величин концентраций, а от их соотношения, то при разбавлении она остается постоянной.
Характеристикой буферных растворов служит величина буферной емкости. Она определяется числом г –экв. сильной кислоты или щелочи, которую необходимо прибавить к 1л буферного раствора для изменения рН на 1 единицу.
2. Слабое основание и его соль:
аммонийная (NH4OH и NH4Cl).
3. Две кислые соли:
фосфатная (Na2HPO4, NaH2PO4).
4. Кислая и средняя соль:
карбонатная (NaHCO3, NaCO3).
Таким образом постоянство рН буферных систем при добавлении кислоты или щелочи объясняется связыванием вводимых ионов Н+ и ОН-.
Кислые или щелочные стоки, попадающие в водоем могут быть нейтрализованы карбонатной буферной системой природных вод. (Н2СО3, NaHCO3).
В щелочных водах (при рН >8,5) буферность природных вод определяется другой карбонатной системой (NaHCO3, Na2CO3). Поддержание оптимальной величины рН при биологической очистке стоков необходимо для протекания биохимических процессов.
Буферные свойства иловой воды обуславливаются наличием карбонатной, аммонийной и фосфатной систем. Буферные растворы используются при проведении анализа - аммонийный при комплексометрическом определении жесткости воды и т.д.
|
|
|


