 |
Направление протекания ОВР
|
|
|
|
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ ПО ТЕМЕ
«ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ И ЭЛЕКТРОХИМИЧЕСКИЕ
ПРОЦЕССЫ»
ПО ДИСЦИПЛИНЕ «ХИМИЯ»
Учебно-методическое пособие
ЧЕРЕПОВЕЦ
Практические занятия по теме «Окислительно-восстановительные реакции и электрохимические процессы» по дисциплине «Химия»: Учеб.-метод. пособие. Череповец: ГОУ ВПО ЧГУ, 2005. 45 с.
Рассмотрено на заседании кафедры химии, протокол № 11 от 09.06.2004 г.
Одобрено редакционно-издательской комиссией Института металлургии и химии ГОУ ВПО ЧГУ, протокол № 6 от 21.06.2004 г.
Составители: О.А. Калько – канд. техн. наук, доцент; Н.В. Кунина
Рецензенты: Т.А. Окунева, доцент (ГОУ ВПО ЧГУ);
Г.В. Козлова, канд. хим. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.В. Козлова – канд. хим. наук, доцент
© ГОУ ВПО Череповецкий государст-
 венный университет, 2005
венный университет, 2005
ВВЕДЕНИЕ
Пособие включает в себя краткие теоретические сведения, примеры решения задач и варианты контрольных заданий по теме «Окислительно-восстановительные реакции и электрохимические процессы» курса общей химии. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Химия» для химических и инженерно-технических специальностей.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Реакции, протекающие с изменением степеней окисления элементов в веществах, называются окислительно-восстановительными.
Степенью окисления элемента (СО) называют число электронов смещенных к данному атому от других (отрицательная СО) или от данного атома к другим (положительная СО) в химическом соединении или ионе.
При определении СО рекомендуется использовать следующие правила:
|
|
|
1. СО элемента в простом веществе равна нулю, например: 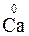 ,
,  .
.
2. СО элемента в виде одноатомного иона в ионном соединении равна заряду иона, например: 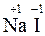 ,
,  ,
, 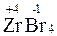 .
.
3. В соединениях с ковалентными полярными связями отрицательную СО имеет атом с наибольшим значением электроотрицательности (ЭО), причем для некоторых элементов характерны следующие СО:
– для фтора – «-1»;
– для кислорода – «-2», за исключением пероксидов, где СО = -1, надпероксидов (СО = -1/2), озонидов (СО = -1/3) и ОF2 (СО = +2);
- для водорода – «+1», за исключением солеобразных гидридов (СО = ‑1), например:  ;
;
- для щелочных и щелочно-земельных металлов СО = +1 и +2 соответственно.
4. Алгебраическая сумма СО всех элементов в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Большинство элементов в веществах проявляют переменную СО. Например, определим СО азота в различных веществах:
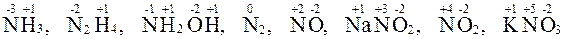 .
.
Любая окислительно-восстановительная реакция (ОВР) состоит из двух сопряженных процессов:
1. Окисление – это процесс отдачи электронов частицей, который приводит к повышению СО элемента:
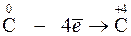
2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением СО элемента:

Вещества, отдающие свои электроны в процессе окисления, называют восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Если обозначить через Ох окисленную форму вещества, а через Red – восстановленную, то любая ОВР может быть представлена в виде суммы двух процессов:
Red 1 – n ē ® Ox 1 (окисление);
Ox 2 + n ē ® Red 2 (восстановление).
Проявление тех или иных окислительно-восстановительных свойств атомов зависит от многих факторов, важнейшие из которых – положение элемента в Периодической системе, его СО в веществе, характер свойств, проявляемых другими участниками реакции. По окислительно-восстановительной активности вещества можно условно разделить на три группы:
|
|
|
1. Типичные восстановители – это простые вещества, атомы которых имеют невысокие значения ЭО (например, металлы, водород, углерод), а также частицы, в которых имеются атомы в минимальной (низшей) для них степени окисления (например, хлор в соединении 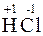 ).
).
2. Типичные окислители – это простые вещества, атомы которых характеризуются высокой ЭО (например, фтор и кислород), а также частицы, в составе которых имеются атомы в высшей (максимальной) СО (например, хром в соединении  ).
).
3. Вещества, обладающие окислительно-восстановительной двойственностью свойств, – это многие неметаллы (например, сера и фосфор), а также вещества, содержащие элементы в промежуточной СО (например, марганец в соединении 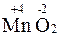 ).
).
Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например:
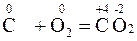
В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными, например:

Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования (самоокисления-самовосстановления), например:
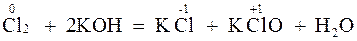
Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений (иначе метод полуреакций). Оба метода основаны на реализации двух принципов:
1. Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым;
2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Метод полуреакций применим для составления уравнений только таких окислительно-восстановительных процессов, которые протекают в растворах. Однако он имеет ряд преимуществ по сравнению с методом электронного баланса. В частности, при его использовании нет необходимости определять степени окисления элементов, кроме того, учитывается роль среды и реальное состояние частиц в растворе.
|
|
|
Основные этапы составления уравнений реакций по методу электронного баланса состоят в следующем:
1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель. Например:
 …
…
Очевидно, что СО изменяется у марганца (уменьшается) и у железа (увеличивается). Таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель.
2. Составляют полуреакции окисления и восстановления:
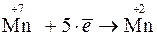 (восстановление)
(восстановление)
 (окисление)
(окисление)
3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:
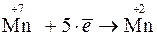 ½´ 1½´ 2
½´ 1½´ 2
 ½´ 5½´ 10
½´ 5½´ 10
Если коэффициенты кратны друг другу, их следует уменьшить, поделив каждый на наибольшее общее кратное. Если коэффициенты нечетные, а формула хотя бы одного вещества содержит четное количество атомов, то коэффициенты следует удвоить.
Так, в рассматриваемом примере коэффициенты перед электронами нечетные (1 и 5), а формула Fe2(SO4)3 содержит два атома железа, поэтому коэффициенты увеличиваем в два раза.
4. Записывают суммарную реакцию электронного баланса. При этом количество принятых и отданных электронов должно быть одинаковым и должно сократиться на данном этапе уравнивания.

5. Расставляют коэффициенты в молекулярном уравнении реакции и вносят недостающие вещества. При этом коэффициенты перед веществами, которые содержат атомы элементов изменявших СО, берутся из суммарной реакции электронного баланса, а атомы остальных элементов уравнивают обычным способом, соблюдая следующую последовательность:
– атомы металлов;
– атомы неметаллов (кроме кислорода и водорода);
– атомы водорода;
– атомы кислорода.
Для рассматриваемого примера
2KMnO4 + 10FeSO4 + 8H2SO4 =
= 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
При уравнивании реакций методом ионно-электронных уравнений соблюдают следующую последовательность действий:
1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель. Например:
|
|
|

СО изменяется у хрома (уменьшается) и у железа (увеличивается). Таким образом, K2Сr2O7 – окислитель, а Fe – восстановитель.
2. Записывают ионную схему реакции. При этом сильные электролиты записываются в виде ионов, а слабые электролиты, нерастворимые и малорастворимые вещества, а также газы оставляют в молекулярном виде. Для рассматриваемого процесса
K+ + Cr2O  + Fe + H+ + SO
+ Fe + H+ + SO  ® Cr3+ + SO
® Cr3+ + SO 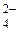 + Fe2+ + H2O
+ Fe2+ + H2O
3. Составляют уравнения ионных полуреакций. Для этого сначала уравнивают количество частиц, содержащих атомы элементов, изменявших свои СО:
Cr2O  ® 2Cr3+
® 2Cr3+
Fe ® Fe2+
Далее уравнивают кислород и водород, используя:
а) в кислых средах Н2О и (или) Н+;
б) в нейтральных средах Н2О и Н+ (или Н2О и ОН-);
в) в щелочных средах Н2О и (или) ОН-.
Cr2O  + 14Н+® 2Cr3+ + 7Н2О
+ 14Н+® 2Cr3+ + 7Н2О
Fe ® Fe2+
Затем уравнивают заряды с помощью прибавления или отнятия определенного количества электронов:
[Cr2O  + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
Fe0 – 2 ē ® Fe2+
4. Балансируют количество принятых и отданных электронов так, как это описано в методе электронного баланса
[Cr2O  + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
Fe0 – 2 ē ® Fe2+ ½´6½´3
5. Записывают суммарную реакцию ионно-электронного баланса:
Cr2O  + 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
+ 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
6. Расставляют коэффициенты в молекулярном уравнении реакции:
K2Cr2O7 + 3Fe + 7H2SO4 = Cr2(SO4)3 + 3FeSO4 + K2SO4 + 7H2O
Расчет молярных эквивалентных масс М Э окислителя или восстановителя в ОВР следует осуществлять по формуле
М Э = 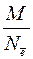 , (1)
, (1)
где М – молярная масса вещества, г/моль; Nē – число электронов, участвующих в процессе окисления или восстановления.
Пример.Уравнять реакцию методом ионно-электронного баланса, вычислить молярные эквивалентные массы окислителя и восстановителя
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO
Р е ш е н и е
Определяем степени окисления элементов, выявляем окислитель и восстановитель
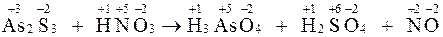
В данном процессе окислитель – НNO3, восстановитель – As2S3.
Составляем ионную схему реакции
As2S3¯ + H+ + NO  ® H+ + AsO
® H+ + AsO  + SO
+ SO 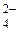 + NO
+ NO
Записываем ионно-электронные полуреакции и балансируем количество принятых и отданных электронов:
[As2S3 + 20H2O]0 – 28 ē ® [2AsO  + 3SO
+ 3SO 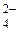 + 40H+]28+ ½´3
+ 40H+]28+ ½´3
[NO  + 4H+]3+ + 3 ē ® [NO + 2H2O]0 ½´28
+ 4H+]3+ + 3 ē ® [NO + 2H2O]0 ½´28
Складываем полуреакции и упрощаем суммарную схему:
3As2S3 + 60H2O + 28NO  + 112H+ ®
+ 112H+ ®
® 6AsO  + 9SO
+ 9SO 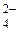 + 120H+ + 28NO + 56H2O
+ 120H+ + 28NO + 56H2O
3As2S3 + 4H2O + 28NO  ® 6AsO
® 6AsO  + 9SO
+ 9SO 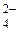 + 8H+ + 28NO
+ 8H+ + 28NO
Переносим коэффициенты в молекулярное уравнение и уравниваем количество атомов каждого элемента:
3As2S3 + 28HNO3 + 4Н2О = 6H3AsO4 + 9H2SO4 + 28NO
Вычисляем молярные эквивалентные массы окислителя и восстановителя по формуле (1):
М э, окислителя =  г/моль;
г/моль;
М э, восстановителя = 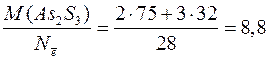 г/моль.
г/моль.
МНОГОВАРИАНТНОЕ ЗАДАНИЕ № 1
|
|
|
По одному из вариантов уравняйте ОВР, используя метод ионно-электронных уравнений. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя:
1. Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
2. FeSO4 + KClO3 + H2SO4 = Fe2(SO4)3 + KCl + H2O
3. Al + Na2MoO4 + HCl = MoCl3 + AlCl3 + NaCl + H2O
4. Sb2O3 + HBrO3 = Sb2O5 + HBr
5. Fe + HNO3 = Fe(NO3)3 + NO + H2O
6. Fe + HNO3 = Fe(NO3)2 + NO2 + H2O
7. Zn + H2SO4 = ZnSO4 + H2S + H2O
8. Zn + HNO3 = Zn(NO3)2 + NO + H2O
9. C + H2SO4 = CO + SO2 + H2O
10. P + HNO3 + H2O = H3PO4 + NO
11. Pb + PbO2 + H2SO4 = PbSO4 + H2O
12. Zn + H2SO4 = ZnSO4 + SO2 + H2O
13. C + HNO3 = CO2 + NO + H2O
14. Na2S + HNO3 = S + NaNO3 + NO + H2O
15. KMnO4 + HCl = MnCl2 + Cl2 + KCl + H2O
16. KIO3 + KI + H2SO4 = I2 + K2SO4 + H2O
17. S + HNO3 = H2SO4 + NO2 + H2O
18. Al + H2SO4 = Al2(SO4)3 + SO2 + H2O
19. FeSO4 + K2Cr2O7 + H2SO4 = Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + + H2O
20. K2Cr2O7 + HCl = CrCl3 + Cl2 + KCl + H2O
21. Zn + HNO3 = Zn(NO3)2 + N2O + H2O
22. K2SO3 + Br2 + H2O = K2SO4 + HBr
23. K2Cr2O7 + KI + H2SO4 = Cr2(SO4)3 + I2 + K2SO4 + H2O
24. Zn + H3AsO3 + HCl = AsH3 + ZnCl2 + H2O
25. HI + H2SO4 = I2 + H2S + H2O
26. Cr2(SO4)3 + K2SO4 + I2 + H2O = K2Cr2O7 + KI + H2SO4
27. MnO2 + KBr + H2SO4 = Br2 + MnSO4 + H2O
28. HClO + FeSO4 + H2SO4 = Fe2(SO4)3 + Cl2 + H2O
29. KMnO4 + K2S + H2SO4 = S + MnSO4 + K2SO4 + H2O
30. CuCl + K2Cr2O7 + HCl = CuCl2 + CrCl3 + KCl + H2O
НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ОВР
Возможность и полнота самопроизвольного протекания ОВР в изобарно-изотермических условиях, как и любого химического процесса, может быть оценена по знаку изменения свободной энергии Гиббса системы D G в ходе процесса. Самопроизвольно при Р, Т = = const в прямом направлении могут протекать реакции, для которых D G < 0.
Изменение энергии Гиббса окислительно-восстановительного процесса также равно электрической работе, которую совершает система по перемещению электронов от восстановителя к окислителю, то есть
 , (2)
, (2)
где D Е – ЭДС окислительно-восстановительного процесса, В; F – постоянная Фарадея (F = 96 485» 96 500 Кл/моль); nē – число электронов, участвующих в данном процессе.
Из уравнения (2) вытекает, что условием самопроизвольного протекания ОВР в прямом направлении является положительное значение ЭДС окислительно-восстановительного процесса (D Е > 0). Расчет ЭДС ОВР в стандартных условиях следует вести по уравнению
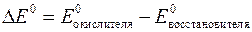 , (3)
, (3)
где  - стандартные окислительно-восстановительные потенциалы систем. Их значения определяются экспериментально и приведены в справочной литературе (для некоторых систем окислительно-восстановительные потенциалы приведены в табл. 1 приложения).
- стандартные окислительно-восстановительные потенциалы систем. Их значения определяются экспериментально и приведены в справочной литературе (для некоторых систем окислительно-восстановительные потенциалы приведены в табл. 1 приложения).
Пример 1.Определите направление протекания ОВР, ионная схема которой следующая:
Fe3+ + Cl- «Fe2+ + Cl2
Р е ш е н и е
В данном процессе ион Fe3+ - окислитель, а ион Cl– - восстановитель. В табл. 1 приложения находим потенциалы полуреакций:
Fe3+ + 1 ē = Fe2+, E 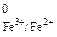 = 0,77 В;
= 0,77 В;
Cl2 + 2 ē = 2Cl-, E 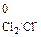 = 1,36 В.
= 1,36 В.
По формуле (3) вычисляем ЭДС:
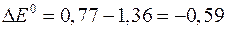 В.
В.
Так как значение D Е 0 < 0, то реакция идет самопроизвольно в обратном направлении.
Пример 2.Можно ли с помощью FeCl3 окислить H2S до элементарной серы?
Р е ш е н и е
Составим ионную схему реакции:
Fe3+ + H2S ® Fe2+ + S + H+
Ион Fe3+ в данном процессе выполняет роль окислителя, а молекула H2S – роль восстановителя.
Находим окислительно-восстановительные потенциалы соответствующих полуреаций: E  = 0,77 В; E
= 0,77 В; E  = 0,17 В.
= 0,17 В.
Потенциал окислителя больше потенциала восстановителя, следовательно, сероводород можно окислить при помощи хлорида железа (III).
МНОГОВАРИАНТНОЕ ЗАДАНИЕ № 2
Уравняйте одну из окислительно-восстановительных реакций, используя метод ионно-электронных уравнений. Пользуясь таблицей стандартных окислительно-восстановительных потенциалов, вычислите ЭДС и D G реакции, а также укажите направление протекания данной ОВР:
1. CuS + H2O2 + HCl = CuCl2 + S + H2O
2. HIO3 + H2O2 = I2 + O2 + H2O
3. I2 + H2O2 = HIO3 + H2O
4. Cr2(SO4)3 + Br2 + NaOH = Na2CrO4 + NaBr + Na2SO4 + H2O
5. H2S + Cl2 + H2O = H2SO4 + HCl
6. I2 + NaOH = NaI + NaIO + H2O
7. Na2Cr2O7 + H2SO4 + Na2SO3 = Cr2(SO4)3 + Na2SO4 + H2O
8. H2S + SO2 = S + H2O
9. I2 + NaOH = NaI + NaIO3 + H2O
10. MnCO3 + KClO3 = MnO2 + KCl + CO2
11. Na2S + O2 + H2O = S + NaOH
12. PbO2 + HNO3 + H2O2 = Pb(NO3)2 + O2 + H2O
13. P + H2O + AgNO3 = H3PO4 + Ag + HNO3
14. P + HNO3 = H3PO4 + NO2 + H2O
15. HNO2 + H2O2 = HNO3 + H2O
16. Bi(NO3)3 + NaClO + NaOH = NaBiO3 + NaNO3 + NaCl + H2O
17. KMnO4 + HBr + H2SO4 = MnSO4 + HBrO + K2SO4 + H2O
18. H2SO3 + H2S = S + SO2 + H2O
19. NaCrO2 + PbO2 + NaOH = Na2CrO4 + Na2PbO2 + H2O
20. NaSeO3 + KNO3 = Na2SeO4 + KNO2
21. KMnO4 + KOH = K2MnO4 + O2 + H2O
22. Pb + NaOH + H2O = Na2 [Pb (OH)4] + H2
23. PbO2 + HNO3 + Mn (NO3)2 = Pb (NO3)2 + HMnO4 + H2O
24. MnO2 K +2SO4 + KOH = KMnO4 + K2SO 3+ H2O
25. NO + H2O + HClO = HNO3 + HCl
26. NO + H2SO4 + CrO3 = HNO3 + Cr2(SO4)3 + H2O
27. MnCl2 + KBrO3 + KOH = MnO2 + KBr + KCl + H2O
28. Cl2 + KOH = KClO + KCl + H2O
29. CrCl3 + NaClO + NaOH = Na2CrO4 + NaCl + H2O
30. H3PO4 + HI = H3PO3 + I2 + H2O
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Процессы превращения энергии химической реакции в электрическую лежат в основе работы химических источников тока (ХИТ). К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы.
Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это – ХИТ одноразового действия.
Если окислитель и восстановитель хранятся вне элемента и в процессе его работы подаются к электродам, которые не расходуются, то такой элемент может работать длительное время и называется топливным элементом.
В основе работыаккумуляторов лежат обратимые ОВР. Под действием внешнего источника тока ОВР протекает в обратном направлении, при этом устройство накапливает (аккумулирует) химическую энергию. Этот процесс называется зарядом аккумулятора. Затем аккумулятор может превратить накопленную химическую энергию в электрическую (процесс разряда аккумулятора). Процессы заряда и разряда аккумулятора осуществляются многократно, то есть это – ХИТ многоразового действия.
Гальванический элемент состоит их двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. Полуэлемент (иначе электрод) чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться. Каждый электрод характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ).
СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р 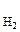 = 1 атм) и раствором, в котором активность ионов водорода а
= 1 атм) и раствором, в котором активность ионов водорода а  = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
Н+ + 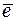 «½ Н2
«½ Н2
Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е  = 0 В).
= 0 В).
Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид:
1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Ме n + :
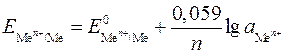 , (4)
, (4)
где Е 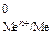 - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а 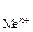 - активность ионов металла в растворе, моль/дм3.
- активность ионов металла в растворе, моль/дм3.
Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе, кроме того Е 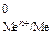 для некоторых металлических систем приведены в табл. 2 приложения.
для некоторых металлических систем приведены в табл. 2 приложения.
При расчетах потенциалов металлических электродов активность ионов металла можно считать приблизительно равной их молярной концентрации а 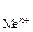 » [Ме n +];
» [Ме n +];
2) для водородного электрода
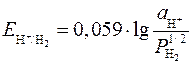 .
.
Если давление водорода считать равным 1 атм, то уравнение Нернста примет вид
 , (5)
, (5)
где рН – водородный показатель воды.
В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией.
Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода
D Е = Е катод – Е анод. (6)
Поскольку потенциал катода всегда больше потенциала анода, то из формулы (6) следует, что в работающем гальваническом элементе D Е > 0.
Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевого мостика – U-образной трубки с раствором электролита.
Пример 1. Определите потенциал никелевого электрода, если концентрация ионов Ni2+ в растворе составляет 0,02 н.
Р е ш е н и е
Определяем молярную концентрацию ионов никеля в растворе:
[Ni2+] = 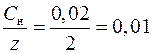 моль/дм3 ,
моль/дм3 ,
где z = 2 – число эквивалентности ионов Ni2+.
Из табл. 2 приложения выбираем Е  = - 0,250 В. По формуле (4) вычисляем потенциал никелевого электрода
= - 0,250 В. По формуле (4) вычисляем потенциал никелевого электрода
 В.
В.
Пример 2. Определите концентрацию ионов ОН- в растворе, если потенциал водородного электрода, помещенного в данный раствор, равен ‑0,786 В.
Р е ш е н и е
Из формулы (5) определяем рН раствора:
 .
.
Тогда гидроксильный показатель воды равен
Р ОН = 14 – р Н = 14 – 13,32 = 0,68.
Отсюда концентрация ионов ОН– равна
 моль/дм3.
моль/дм3.
Пример 3.Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, составленного из свинцового и медного электродов, погруженных в растворы с концентрациями ионов Pb2+ и Cu2+, равными 0,1 М и 0,05 М соответственно.
Р е ш е н и е
Из табл. 2 приложения выбираем Е 0 данных металлов и по формуле (5) вычисляем их потенциалы:
 В;
В;
 В.
В.
Потенциал медного электрода больше потенциала свинцового электрода, значит, Pb – анод, а Cu – катод. Следовательно, в элементе протекают процессы:
на аноде: Pb – 2 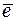 ® Pb2+;
® Pb2+;
на катоде: Cu2+ + 2 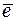 ® Cu;
® Cu;
токообразующая реакция: Pb + Cu2+ = Pb2+ + Cu;
схема элемента: (-) Pb½Pb2+½½Cu2+½Cu (+).
По формуле (6) определяем ЭДС данного гальванического элемента:
D Е = 0,298 – (-0,156) = 0,454 В.
МНОГОВАРИАНТНОЕ ЗАДАНИЕ № 3
Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, составленного из первого и второго металлов, погруженных в растворы с указанной концентрацией ионов металла (табл. 1). Рассчитайте D G токообразующей реакции.
Таблица 1
Таблица исходных данных для многовариантного задания № 3
| Номер варианта | Первый электрод | Второй электрод | Номер варианта | Первый электрод | Второй электрод | ||||
| Me | С Me 
| Me | С Me 
| Me | С Me 
| Me | С Me 
| ||
| Mg | 0,1М | Cd | 0,01 н | Cu | 0,01 М | Zn | 0,01 н | ||
| Zn | 0,01н | Cr | 0,05М | Mn | 0,02 н | Ag | 0,001 н | ||
| Ag | 0,05М | Cu | 0,02 н | Au | 0,2 н | Mn | 0,1 н | ||
| Cu | 0,2 М | Al | 0,03 н | Cd | 0,03 М | Mg | 0,2 н | ||
| Mn | 0,02 н | Zn | 0,1 М | Sn | 0,02 н | Cu | 0,01 М | ||
| Co | 0,05 н | Mg | 0,01 М | Cr | 0,03 М | Ti | 0,1 М | ||
| Cr | 0,03 н | Mn | 0,2 М | Ag | 0,2 н | Hg | 0,02 М | ||
| AI | 0,03 н | Sn | 0,002 н | Mg | 0,01 М | Cr | 0,03 н | ||
| Sn | 0,2 М | Pb | 0,02 н | Co | 0,05М | Fe | 0,001 н | ||
| Pb | 0,1 н | Ag | 0,01 н | Mg | 0,2 М | Pb | 0,02 н | ||
| Cd | 0,2 н | Fe | 0,05М | Pb | 0,02 М | AI | 0,03 н | ||
| Au | 0,03 н | Co | 0,2 М | Fe | 0,01 М | Sn | 0,1 н | ||
| Ti | 0,02 н | Au | 0,03 н | Al | 0,2 н | Ni | 0,02 М | ||
| Fe | 0,03 н | Zn | 0,02 М | Zn | 0,03 М | Co | 0,001 н | ||
| Hg | 0,01 М | Ni | 0,1 н | Sn | 0,02 М | Cd | 0,2 н |
|
|
|


