 |
Электролиз. Законы фарадея
|
|
|
|
Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую, что позволяет осуществлять такие ОВР, которые не могут протекать самопроизвольно.
Ячейка, в которой осуществляют электролиз, называется электролизёром и состоит из двух электродов и электролита. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем происходит окисление. Электрод, подключенный к отрицательному полюсу, называется катодом, на нем идет восстановительный процесс.
Минимальное напряжение электрического тока, приложенное к электродам, при котором начинается электролиз вещества, называется потенциалом разложения U разл. Теоретически U разл должен быть равен разности окислительно-восстановительных потенциалов процессов, протекающих на электродах
U разл = Е анодного процесса – Е катодного процесса. (7)
Однако на практике, чтобы начался электролиз, к электродам приходится прикладывать напряжение, заметно превышающее потенциал разложения вещества.
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.). Различают электролиз расплавов и электролиз водных растворов.
Электролиз расплавов электролитов обычно ведут с использованием инертных (неактивных, нерасходуемых) электродов, то есть электродов, выполненных из материалов, которые в процессе электролиза химически не изменяются, а служат лишь для передачи электронов. Инертные электроды обычно изготовляются из графита, угля, платины. Кроме инертных анодов различают также растворимые (активные, расходуемые) аноды. Это аноды, выполненные из активных материалов (меди, цинка, никеля, железа и других металлов). У таких анодов в процессе электролиза окисляется в первую очередь сам материал анода.
|
|
|
Рассмотрим процессы, протекающие при электролизе расплава хлорида магния. При плавлении MgCl2 (как и любого другого ионного соединения) происходит его термическая диссоциация по уравнению
MgCl2 ® Mg2+ + 2Cl–
Если в такой расплав погрузить инертные электроды и пропускать электрический ток, то в электролите начнется направленное движение ионов: положительно заряженные ионы (катионы) будут двигаться к отрицательному электроду (катоду), а отрицательно заряженные ионы (анионы) направятся к аноду. Схематично эти процессы на примере MgCl2 можно представить так:
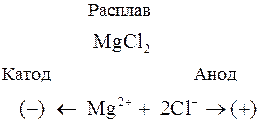
На электродах будут протекать следующие процессы:
1) восстановление катионов на катоде
Mg2+ + 2 ē ® Mg
2) окисление анионов на аноде
2Cl– – 2 ē ® Cl2
Суммарная реакция электролиза расплава хлорида магния
MgCl2 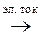 Mg + Cl2
Mg + Cl2
Электролиз водных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды:
1) восстанавливаться на катоде по схеме
2Н2О + 2 ē ® Н2 + 2ОН–
2) окисляться на аноде по схеме
2Н2О – 4 ē ® О2 + 4Н+
Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает:
1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала;
|
|
|
2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала.
При реализации данных принципов на практике следует вычислить потенциалы всех возможных процессов и сравнить их между собой. На катоде при этом могут возникнуть три случая:
1. Потенциал восстановления катиона Е 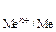 больше потенциала восстановления воды Е
больше потенциала восстановления воды Е 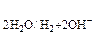 , причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
, причем абсолютная разность между потенциалами конкурирующих процессов ½D Е ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
Mе n + + nē ® Me
2. Е 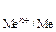 < Е
< Е 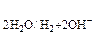 , причем
, причем 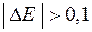 В, тогда на катоде идет процесс восстановления молекул воды.
В, тогда на катоде идет процесс восстановления молекул воды.
3. Е 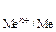 » Е
» Е 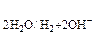 , то есть
, то есть 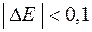 В, тогда на катоде идут сразу оба восстановительных процесса:
В, тогда на катоде идут сразу оба восстановительных процесса:
Mе n + + 2Н2О + (2 + n) ē ® Me + Н2 + 2ОН–
Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода
Fe – 2 ē ® Fe2+
Если анод инертный, то окислению будет подвергаться одна из частиц электролита (анион или молекула воды). В реальных процессах порядок разряда частиц на инертном электроде зависит не только от окислительно-восстановительного потенциала системы, но и от перенапряжения. А нодное перенапряжение при окислении молекул воды (кислородное перенапряжение), то есть сдвиг потенциала окисления Н2О в положительную сторону, связано с кинетическими затруднениями при образовании молекулы О2. В результате теоретически выделение кислорода должно начинаться при потенциале +0,815 В, а практически это происходит только при напряжении более + 1,5 В.
Для реальных процессов окисления на инертном аноде выполняется следующее:
1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2–, I–, Br–, Cl–. Вода при этом не окисляется.
2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО 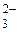 , NO
, NO  , SO
, SO 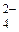 и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
|
|
|
2Н2О – 4 ē ® О2 + 4Н+,
а в щелочных растворах – ионы ОН– по схеме
4 ОН– – 4 ē ® О2 + 2Н2О
Зависимость между количеством электричества и массой вещества, испытавшего превращение на электроде, устанавливается законами Фарадея:
Первый закон Фарадея: масса вещества, испытавшего электрохимические превращения на электроде, прямо пропорциональна количеству прошедшего через электролизер электричества.
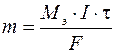 , (8)
, (8)
где m – масса вещества, г; M э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с.
Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой
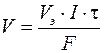 , (9)
, (9)
где V э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3.
Второй закон Фарадея: массы веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов
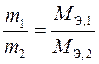 . (10)
. (10)
Пример 1. Запишите реакции, протекающие на графитовых электродах при электролизе водного раствора бромида никеля, если концентрация соли в растворе равна 0,1 моль/дм3, а рН раствора равен 8.
Р е ш е н и е
Бромид никеля NiBr2 – сильный электролит, то есть в растворе распадается на ионы по схеме
NiBr2 ® Ni2+ + 2Br–
У катода будут находиться частицы Ni2+ и Н2О, которые могут восстановиться следующим образом:
а) Ni2+ + 2 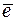 ® Ni
® Ni
б) 2Н2О + 2 ē ® Н2 + 2ОН–
Определяем потенциалы конкурирующих процессов по уравнению Нернста [формулы (4) и (5) соответственно]:
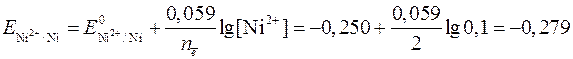 В;
В;
Е 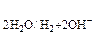 = –0,059 × рН = –0,059 × 8 = –0,472 В.
= –0,059 × рН = –0,059 × 8 = –0,472 В.
Окислительно-восстановительный потенциал никеля больше потенциала восстановления воды более чем на 0,1 В, значит, на катоде происходит восстановление только ионов Ni2+.
На инертном аноде будут окисляться ионы брома, так как у молекул воды окислительно-восстановительный потенциал с учетом кислородного перенапряжения выше, чем потенциал выделения брома.
Таким образом, при электролизе раствора NiBr2 на графитовых электродах реализуются процессы:
на катоде: Ni2+ + 2 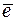 ® Ni;
® Ni;
|
|
|
на аноде: 2Br– – 2 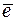 ® Br2;
® Br2;
суммарная реакция: NiBr2 ® Ni + Br2.
Пример 2.Какие вещества и в каких количествах выделятся на железных электродах при электролизе водного раствора NaOH в течение 2 часов при силе тока 1,5 А?
Р е ш е н и е
У катода будет происходить восстановление молекул воды, так как потенциал восстановления ионов Na+ гораздо более отрицательный, чем у Н2О. На железном (активном) аноде будет происходить окисление материала анода. Таким образом:
на катоде: 2Н2О + 2 ē ® Н2 + 2ОН– ;
на аноде: Fe – 2 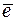 ® Fe2+ ;
® Fe2+ ;
суммарная реакция: Fe + 2H2O ® H2 + Fe(OH)2.
По формуле (8) определяем массу гидрооксида железа (II):
 г.
г.
По формуле (9) определяем объем водорода при нормальных условиях:
 дм3.
дм3.
МНОГОВАРИАНТНОЕ ЗАДАНИЕ № 4
Для раствора заданного электролита с известным значением концентрации и рН (табл. 2) при электролизе с графитовыми электродами:
1. Записать реакции на электродах и суммарную реакцию;
2. Рассчитать массы веществ (для газов – объемы), испытавших превращение на электродах при силе тока I и времени электролиза t;
Определить потенциал разложения в стандартных условиях.
Таблица 2
Таблица вариантов к заданию № 4
| № п/п | Электро-лит | С М,
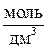
| I, А | t, ч | рН | № п/п | Электро-лит | С М,
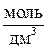
| I , А | t, ч | рН |
| MgSO4 | 0,1 | K3PO4 | 0,01 | 0,5 | |||||||
| KI | 0,2 | CdSO4 | 0,02 | ||||||||
| CuNO3 | 0,3 | 0,5 | Pb(NO3)2 | 0,03 | 0,2 | ||||||
| NaBr | 0,4 | 1,5 | MgCl2 | 0,04 | 0,5 | ||||||
| K2S | 0,5 | Na2SO4 | 0,05 | ||||||||
| KClO3 | 0,6 | 2,5 | BaCl2 | 0,06 | |||||||
| CuSO4 | 0,7 | MnBr2 | 0,07 | ||||||||
| Na3PO4 | 0,8 | ZnSO4 | 0,08 | 1,5 | |||||||
| AgNO3 | 0,9 | 5,5 | 0,5 | NiI2 | 0,09 | ||||||
| CaBr2 | 1,0 | CrCl3 | 0,10 | ||||||||
| ZnCl2 | 1,1 | FeSO4 | 0,11 | 0,5 | |||||||
| Cr2(SO4)3 | 1,2 | 3,5 | FeCl3 | 0,12 | |||||||
| NiSO4 | 1,3 | Co(NO3)2 | 0,13 | ||||||||
| Mn(NO3)2 | 1,4 | 0,5 | SnSO4 | 0,14 | 1,5 | ||||||
| SnCl2 | 1,5 | AI(NO3)3 | 0,15 |
КОРРОЗИЯ МЕТАЛЛОВ
Коррозия – это самопроизвольное разрушение металлов или сплавов металлов в результате их физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии. Причиной коррозионных разрушений является термодинамическая неустойчивость материалов в естественных условиях, т.е. изменение энергии Гиббса процесса коррозии должно быть отрицательным (D G < 0).
По механизму протекания различают химическую и электрохимическую коррозию.
Химическая коррозия протекает в средах, не проводящих электрический ток, таких как сухие газы или растворы неэлектролитов. В результате химической коррозии металл покрывается слоем продуктов его окисления – чаще всего пленкой оксида или гидрооксида. Образующаяся пленка препятствует диффузии окислителя к чистому металлу и тем самым замедляет, а иногда и полностью прекращает дальнейшую коррозию металла.
|
|
|
Электрохимическая коррозия наблюдается в средах, способных проводить электрический ток (влажный воздух, вода, водные растворы солей, кислот и оснований, почва и др.). Данный вид коррозии протекает по механизму действия гальванического элемента, в котором окислительный (анодный) и восстановительный (катодный) процессы разделены в пространстве.
Окисляющиеся участки металла (анодные участки) имеют меньшее значение потенциала, на них металл в виде ионов переходит в водную среду по реакции
Mе – nē ® Me n +
При этом на металле накапливается отрицательный заряд.
На катодных участках, то есть участках с более высоким значением потенциала, восстанавливаются частицы окислителя
Ox + n ē ® Red
Так как окислитель принимает электроны, то есть снимает избыточный отрицательный заряд с поверхности металла (деполяризует его), то его называют деполяризатором.
Причинами энергетической неоднородности поверхности металла, которые приводят к образованию короткозамкнутых макро- или микрогальванических пар, являются:
1) наличие контактов двух или более металлов, обладающих различными значениями потенциалов;
2) наличие примесей в металле или продуктов его окисления на поверхности;
3) внутренние напряжения в конструкции из металла и др.
Окислителями при электрохимической коррозии чаще всего служат молекулы кислорода, растворенного в воде или ионы Н+. При этом на катодных участках могут происходить процессы:
1) в нейтральной или щелочной среде
О2 + 2Н2О + 4 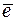 ® 4ОН– (коррозия с кислородной деполяризацией)
® 4ОН– (коррозия с кислородной деполяризацией)
2) в кислой среде
О2 + 4Н+ + 4 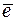 ® 2Н2О (коррозия с кислородной деполяризацией)
® 2Н2О (коррозия с кислородной деполяризацией)
или
2Н+ + 2 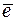 ® Н2 (коррозия с водородной деполяризацией)
® Н2 (коррозия с водородной деполяризацией)
Возможность протекания коррозии того или иного металла следует определять следующим образом: сравнить потенциал металла (восстановителя) с потенциалом окислителя. Если Е 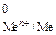 < Е
< Е 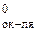 , то металл может корродировать.
, то металл может корродировать.
При оценочных расчетах можно считать, что потенциал процесса с кислородной деполяризацией равен +0,815 В, а потенциал процесса с водородной деполяризацией можно оценивать при помощи уравнения (5).
Явление коррозии материалов наносит огромный ущерб экономике любой страны, поэтому разработаны меры по защите материалов от коррозии. Основными способами защиты металлов от коррозии являются легирование металлов, нанесение защитных покрытий, методы электрохимической защиты, применение замедлителей (ингибиторов) коррозии и приемы рационального конструирования изделий из металлов.
Одним из самых доступных и чаще всего применяемых методов защиты является нанесение на металлы покрытий, которые бывают металлическими и неметаллическими.
Материалами для металлических покрытий могут служить как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их делят на катодные и анодные.
К катодным покрытиям относят покрытия, выполненные из металлов, имеющих большее значение потенциала, чем у основного (защищаемого) металла. При повреждении такого покрытия возникает макрогальванический элемент, в котором защищаемый металл становится анодом и растворяется, а металл покрытия – катодом, на котором восстанавливаются частицы окислителя. Таким образом, катодные покрытия являются защитными, только пока они не повреждены.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. В случае повреждения анодного покрытия его защитное действие не прекращается, так как в созданном гальваническом элементе основной металл – катод (то есть не окисляется), а металл покрытия – анод.
Пример 1.Напишите уравнения анодного и катодного процессов, протекающих при коррозии железа, покрытого никелем в серной кислоте (рН = 4) для случаев:
а) покрытие целостное; б) покрытие нарушено.
Какой металл или какие металлы при этом разрушаются и какие продукты образуются вследствие коррозии?
Р е ш е н и е
По табл. 2 приложения определяем значения стандартных потенциалов контактирующих металлов: Е 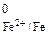 = –0,440 В, Е
= –0,440 В, Е 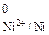 =
=
= –0,250 В. Поскольку потенциал никеля больше потенциала железа, значит, покрытие – катодное.
В случае целостности покрытия окислитель не имеет физического контакта с основным металлом, поэтому он может воздействовать только на покрытие. При коррозии в серной кислоте окислителем являются ионы Н+. Вычисляем потенциал водородного электрода при рН = 4 по формуле (5):
Е 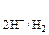 = –0,059 × рН = –0,059 × 4 = – 0,236 В.
= –0,059 × рН = –0,059 × 4 = – 0,236 В.
Расчет показал, что Е 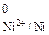 < Е
< Е 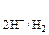 , следовательно, коррозия никеля в серной кислоте при рН = 4 возможна:
, следовательно, коррозия никеля в серной кислоте при рН = 4 возможна:
на катодных участках (Ni): 2H+ + 2 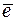 ® H2;
® H2;
на анодных участках (Ni): Ni – 2 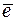 ® Ni2+.
® Ni2+.
Таким образом, если покрытие не нарушено, то коррозии подвергается никель, при этом образуются продукты: Н2 и NiSO4.
При нарушении катодного покрытия возникает гальванический элемент, в котором железо – анод, а никель – катод. Так как Е 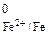 < < Е
< < Е 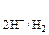 , то коррозия железа с водородной деполяризацией возможна:
, то коррозия железа с водородной деполяризацией возможна:
на катодных участках (Ni): 2H+ + 2 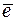 ® H2;
® H2;
на анодных участках (Fe): Fe – 2 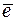 ® Fe2+;
® Fe2+;
Продуктами коррозии в этом случае являются Н2 и FeSO4.
Пример 2. Оцените термодинамическую возможность коррозии олова во влажном воздухе и в кислой среде с рН = 3 без доступа кислорода.
Р е ш е н и е
Во влажном воздухе окислителем является кислород, растворенный в воде, то есть будет протекать коррозия с кислородной деполяризацией. В кислых средах без доступа кислорода окисляющими частицами являются ионы Н+, то есть может протекать коррозия с водородной деполяризацией.
По табл. 2 приложения определяем Е 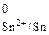 = –0,136 В. По формуле (5) вычисляем потенциал водородного электрода при рН = 3:
= –0,136 В. По формуле (5) вычисляем потенциал водородного электрода при рН = 3:
Е 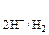 = –0,059 × рН = –0,059 × 3 = –0,177 В.
= –0,059 × рН = –0,059 × 3 = –0,177 В.
Поскольку Е 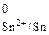 > Е
> Е 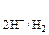 , значит, коррозия олова в кислой среде при рН = 3 невозможна.
, значит, коррозия олова в кислой среде при рН = 3 невозможна.
Сравнивая Е 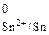 с потенциалом процесса кислородной деполяризации, который равен +0,815 В, получаем, что коррозия олова во влажном воздухе может протекать.
с потенциалом процесса кислородной деполяризации, который равен +0,815 В, получаем, что коррозия олова во влажном воздухе может протекать.
МНОГОВАРИАНТНОЕ ЗАДАНИЕ № 5
По одному из вариантов для пары металлов (табл. 3), считая первый металл основным, а второй – покрытием:
1. Напишите уравнения анодного и катодного процессов и определите, какие продукты образуются при коррозии во влажном воздухе в случае целостного покрытия и при его нарушении. Укажите, к какому типу относится покрытие;
2. Определите термодинамическую возможность коррозии каждого металла по отдельности в кислой среде при указанном значении рН. Запишите уравнения возможных коррозионных процессов;
3. Предложите для данной пары металлов катодное и анодное покрытие.
Таблица 3
Таблица вариантов к заданию № 5
| Номер варианта | Пары металлов | рН | Номер варианта | Пары металлов | рН | Номер варианта | Пары металлов | рН |
| Mg – Cr | Pb – Cu | Pb – Sn | ||||||
| Zn – Cd | Cu – Ag | Cd – Mg | ||||||
| Cd – Fe | Cr – Sn | Cu – Cr | ||||||
| Fe – Cr | – AI Mn | AI – Pb | ||||||
| Ni – Sn | Cu – Fe | Cr – Sn | ||||||
| Ag – Pb | Mn – Zn | Co – Cu | ||||||
| Mn – Co | Sn – Ag | Ag – Mn | ||||||
| Co – Fe | Cu – Zn | Mg – Ni | ||||||
| Sn – Pb | Sn – Pb | Ni – AI | ||||||
| Cd – AI | Zn – Fe | Zn – Sn |
Список литературы
1. Коровин Н.В. Общая химия. М.: Высш. шк., 1998.
2. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. М.: ООО «Дрофа», 2002.
3. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Изд-во «Астрель», 2004.
5. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
6. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
7. Задачи и упражнения по общей химии / Под ред. Коровина Н.В. М.: Высш. шк., 2003.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Высш. шк., 1991.
Приложение
Таблица 1
|
|
|


