 |
Аппаратное оформление процессов с Г/Т составом фаз.
|
|
|
|
Вопрос
 |



 2NH3 + CO2 + H2O = (NH4)2CO3
2NH3 + CO2 + H2O = (NH4)2CO3


 (NH4)2CO3 + CO2 + H2O = 2NH4HCO3
(NH4)2CO3 + CO2 + H2O = 2NH4HCO3
NH4HCO3 + NaCl – NaHCO3 + NH4Cl
 2NaHCO3 = Na2CO3 + H2O + CO2
2NaHCO3 = Na2CO3 + H2O + CO2
 CaCO3 = CaO + CO2
CaCO3 = CaO + CO2
 C + O2 = CO2
C + O2 = CO2
CaO + H2O = Ca(OH)2
 2NHCl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
2NHCl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
Основное количество углерода, необходимое для карбонизации получают обжигом известняка. Разложение известняка идёт с поглощением тепла образующевося при сгорании углерода. Образовавшийся оксид кальция поступает на приготовление известкового молока — суспензии Са(ОН)2.
Гидроксид кальция используется для регенерации аммиака на стадии дистилляции. В качестве отхохда производства образуется раствор хлорида кальция CaCl2. Химическая схема может рассказать выбор сырья. В схеме существует несколько циклов: это цикл аммиака, включающий абсорбцию, химическое взаимодействие, фильтрование, дистилляцию, и цикл углекислого газа включающий в себя карбонизацию, фильтрование, кальцинацию.
Схема процесса регенерации аммиака в производстве соды.
Блоки и потоки.

Потоки.
1. Фильтрат с вращающихся барабанных фильтров.
2. Газ содержащий аммиак.
3. Конденсат содержащий раствор аммиака.
4. Газ содержащий аммиак перед абсорбцией.
5. Известковое молоко.
6. Вода после дистилляции конденсата.
7. Жидкость отохдящая из дистиллёра.
8. Греющий пар.
9. Охлаждающая вода.
10. Вода из холодильников.
Структурная схема наглядно показывает технологические связи между блоками. А технологические связи указывают движение материальных и энергетических потоков.
Блоки.
Операторная схема другого процесса.
Технологическая схема производства соды.
Произвдоство соды начинается с добычи и очистки раствора поваренной соли.
Рассол, получаемый подземным выщелачиванием соляных пластов, донасыщается каменной солью до концентрации 305 — 310 кг / м^3.
|
|
|
Перед использованием в аммиачно содовом производстве, рассол очищают от солей Ca2+ Mg+, известково — содовым методом. Очищенный раствор из напорного бака, самотёком поступает в абсорбционные колонны, где происходит насыщение рассола аммиаком, и в некоторой степени диоксидом углерода. Абсорбция ведётся последовательно в нескольких колоннах. После каждой ступени раствор охлаждается в теплообменниках. Одновременно с аммиаком, в колонны подаются отходящие газы из абсорбционных колонн, фильтров и карбонизационных. Аммонизированный рассол из колонны 4 подаётся в карбонизационную колонну 5. В нижней части колонны расположены холодильники, по которым циркулирует холодная вода. В нижнюю и среднюю части колонны, компрессорами подаётся диоксид углерода из печей кальцинации 7, и печной газ из печи 1. Гидрокарбонатная суспензия из колонны 5 самотёком передаётся в отделение фильтрования, где на барабанных вакуум фильрах 6, осадок гидрокарбоната отделяется от раствора хлорида аммония. Сырой гидрокарбонат натрия подаётся в печь кальцинации 7. Барабанная печь снаружи обогревается топочными газам. Температура внутри печи 140 — 170 градусов. Газы кальцинации, после охлаждения и промывки водой, подаются на карбонизацию. Фильтровая жидкость поступает в отделение регенерации аммиака, подогревается в теплообменниках и подаётся в дистиллёры 3. Туда же подаётся известковое молоко из гасителей 2. В нижнюю часть дистиллёра подаётся водяной пар. Из нижней части дистиллёра, отводится раствор хлорида кальция в шламовые бассейны. Оксид кальция, для получения известкового молока производится в шахтной печи 1. Температура обжига — 1100 — 1200 градусов. Размеры кусков известняка от 40 до 120 мм, а размеры кусков угля 40 — 80 мм. Известковое молоко получается гашением оксида кальция водой во вращающихся барабанах 2. Содержание гидроксида кальция в суспензии составляет от 270 до 308 кг/м^3.
|
|
|
Вопрос
Технологические связи элементов ХТС, их назначение и характеристика. Отдельные элементы ХТС связаны технологическими связями. Различают несколько типов связей. Рассмотрим пять: последовательная, параллельная, последовательно — обводная, циклическая и перекрёстная связь.
Последовательная связь — это схема с открытой цепью состоящей из аппаратов, через которые все реагирующие компоненты проходят лишь один раз.
 |
Са — концентрация вещества А
ха — степень превращения вещества А.
Последовательная связь применяется тогда, когда необходимо провести химическое превращение в несколько стадий, при чём на каждой стадии необходимо выбрать оптимальные параметры. Суммарную степень превращения А, можно определить из соотношения
дельта х общ = дельта ха1 + дельта ха2 + …. + дельта хаn, где
дельта ха1 = ха1 — ха0
Число реакторов, при равенстве их объёма, можно определить по уравнени: м = t * u / Vзета; дельта ха2 = ха2 — ха1.
t — время пребывания реагента в реакторе.
u — производительность в объёмных единицах.
V — объём реактора.
зета — коэффициент запаса.
Параллельная связь применяется для повышения мощности и производительности ХТС без увеличения мощщности отдельных реакторов. При параллельном получении из одного исходного вещества нескольких продуктов.
Операторная схема.
 |
Последоваельная обвдоная технологическая свзяь — байпас, это такая связь, при которой часть выходного потока обходит один или несколько аппаратов и затем соединяется с основной частью потока.
Операторная схема.
 |
Используется для проведения обратимых экзотермических реакций в адиабатических реакторах. Введение байпасного потока позволяет регулировать температуру потока.
Обратная технологическая связь — рецикл, характеризуется наличием обратного потока в системе последовательно соединённых элементов.
Фракционный рецикл.
Простой рецикл.
 |
V с буковй это массове расходы соответствующих потов
Коэффициент рецеркуляции R, показвает, какая доля главного потока, после его разветвления возвращается в процесс:
|
|
|
R = побочный поток/главный поток = Ve/Vb = Ve/Vc.
Коэффициент циркуляции Кц показывает во сколько раз главный поток больше
прямого:
Ку = главный поток/прямой поток = Vb/Va = Vc/Vd.
Между коэффициентами имеется связь.
Главный поток равен сумме прямого и побочного потоков.
Vb = Va + Ve; Vc = Vd + Ve.
R = 1 — 1/Кц; Кц = 1/(1 — Кц).
В одной схеме может быть несколько рециклов.

 А1 обратимо превращается в А2 и А3, а продукт А2 обратимо превращается в продукт А4.
А1 обратимо превращается в А2 и А3, а продукт А2 обратимо превращается в продукт А4.
|
 |
Перекрёстная технологическая связь, применяется для рационального использования энергии в химико-технологических системах.
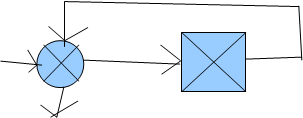 |
Вопрос
Синтез и анализ ХТС.
При проектировании новых производств, или при исследовании действующих производств, с целью повышения их эффективности, перед технологом возникают три класса задач - это анализ, оптимизация и синтез ХТС.
Анализ ХТС состоит в определении значений параметров выходных и промежуточных потоков. Критерии эффективности ХТС, при заданных технологических параметрах аппаратов.
Цель анализа ХТС заключается в изучении свойств и эффективности функционирования на основе её математической модели.
Задача оптимизации ХТС, заключается в оптимизации режимов функционирования элементов. Цель оптимизации — обеспечение наиболее высоких технико-экономических показателей.
Зачача синтеза ХТС заключается в выборе основных технологических операций, структурных технологических связей, и параметров технологического режима отдельных элементов, и параметров системы, которые должны обеспечить нормальное функционирования системы. Для решения задач синтеза, существуют технологические принципы или концепции создания ХТС.
Рассмотрим некоторые из этих концепций.
1. Глубина переработки сырья в продукты.
Глубина переработки сырья в продукты — это требование максимально возможного выхода полезного продукта. Некоторые решения этой концепции следующие:
а) выбор процесса на пример хлорвинил можно получитьв две стадии, как хлорирование этилена с последующим дегирдрохлорированием
|
|
|
C2H4 + Cl2 (кат)= CH2ClCH2Cl
CH2ClCH2Cl (400 — 500 гр. С) разложение = CH2CHCl + HCl
Общий выход хлорвинила примерно 90%,
Можно выбрать другой процесс — окислительное гидрохлорирование этилена
2СH2CH2 + 2HCl = 2 CH2CHCl + 2H2О, выход хлорвинила при этом примерно 95%;
б) избыток одного из реагентов, обычно в избытке берут более дешёвый и более доступный реагент, рассмотрим конверсию метана водяным паром
CH4 + H2O = CO + 3H2, если соотношение газов 1:1, то альфа СН4 = 48% P = 3МПа t = 900 гр. С.1:1
Если водяной пар в четырёхкратном избытке, то альфа СН4 = 94% при тех же условиях. 1:4;
в) противоточный контак фаз обеспечивает наибольшую полезную движущую силу процецсса;
г) фракционный рецикл — после выделения продукта, сырьё возвращается на повторную обработку.
2. Полнота переработки сырья.
Полнота переработки сырья — это требование максимаольного превращения сырья в конечные продукты.
Некотоыре решения этой концепции:
а) этилен получают пиролизом нефти, а при производстве хлорвинила получается хлороводород, если изменить условия пиролиза нефти, то на ряду с этиленом, получается ацетилен в равном количестве, образующийся при хлорировании этилена хлористый водород, можно направить на гидрохлорирование этилена:
С2Н2 + Hcl = СН2=СНCl
|







|










|
|




|



|







|


 Нефть
Нефть
г) Регенирация сырья к примеру аммиак в производстве соды, регенирируют и возвращают в процесс;
в) утилизация отходов позволяет получить полезные продукты из отходящего потока;
г) совмещение производств позволяет использовать один из побочных продуктов в дургом химическом приозводстве, на пример выделяемый при моноэтаноламиновой очистке диоксид углерода, можно направить на синтез карбамида, используя аммиак основного производства.
3. Принцип рациоального использования энергии
Некоторые решения:
а) регенерация тепла(использование перекрёстных связей);
б) регенерация энергии(использование турбин);
в) утилизация тепла;
г) энерготехнологическая ХТС.
Вопрос
Химические процессы и реакторы.
Классификация химико — технологических процессов.
| Признак классификации | Название процесса | Пример |
| 1. По параметру технологического режима | Температура. Низкотемпературные, Высокотемпературные процессы, Плазмохимические процессы t>10^3 гр. С | CaCl2 + Na2CO3= CaCO3 в осадок + 2NaCl t = 20 гр. Ц CaC2 + N2 = Ca(CN)2 цианамид кальнция + C t = 100 гр. Ц Взаимодействие молекулярного азота с кислоородм. N2 + O2 = 2NO t = 3000 гр. С |
| Наличие катализатора. Каталитические, Некаталитические процессы | 2SO2 + O2 (V2O5) = 2SO3 4FeS2 + 11O2 = 2Fe2O3 8SO2 | |
| P. Под повышенным P Под пониженным P | N2 + 3H2 = 2NH3 P = 31,4 Мпа (среденее давление) C6H5C2H5 = C6H5CHCH2стирол + H2 | |
| Воздействие электрического тока. Электрохимические реакции. | 2NaCl + 2H2O = 2NaOH + Cl2 + H2 | |
| Биохимические процессы | C6H12O6 = 2C2H5OH + 2CO2 | |
| Фотохимические процессы | H2 + Cl2 = 2HCl | |
| Радиациооно — химические процссы(под действием альфе; бета; гамма излучений) | ||
| 2. По направлению движения потоков | Прямоточные, противоточные, перекрёстные, смешанные токи. | |
| 3. По агрегатному состоянию реагирующих веществ. | Гомогенные, гетерогенные процессы. | 2NO = N2O2 + O2 = 2NO2 Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH |
| 4. По термодинамическому признаку. | Обратимость: существуют обратимые и не обратимые процессы. | 2NH3 + CO2 = (NH2)2CO + H2O суммарно Ca(OH)2 + SO2 = CaSO3 + H2O |
| Тепловой эффект. Экзотермические(Q>0$ дельтаH<0), эндотермические(Q<0; дельтаН>0) | 4NH3 + 5O2 = 4NO + 6H2O + 946 кДЖ CH4 + H2O = CO + 3H2 – 206 кДж |
Вопрос
|
|
|
Гомогенные процессы — это процессы, протекающие в одной фазе(жидкой или газообразной) не имеющей поверхности раздела.
Действительно гомогенные системы получить тяжело, и обычно в производстве за них принимают жидкофазные и газофазные реакции. В гомогенных ситсемах, реакции протекают гораздо быстрее, чем в гетерогенны, по этому реакции стараются проводить в гомогенной среде. Для получения жидкой среды, в промышленности используют поглощение(абсорбцию) газов или конденсацию паров, растворение или плавление твёрдых материалов. Для проведения реакций в газовой фазе, применяют испарение жидкостей или десорбцию из них в газовую фазу нужных компонентов.
Примеры. При сернокислотной гидратации этилена, процесс начинают с физической абсорбции этилена серной кислотой, а за тем, в жидкой фазе, осуществляется образование этилсерной кислоты и её последующий гидролиз.
C2H4 + H2SO4 = C2H5OSO3H.
C2H5OSO3H + Н2О t = 100 гр. С = С2Н5 ОН + Н2SO4.
Гомогенные процессы в газовой фазе, широко используются в технологии органического синтеза. Обычно, органическое вещесто испаряется, а его пары обрабатываются газообразным компонентом (хлором, диоксидом серы, кислородом, оксидами азота) На пример, при производстве моющих средств, используется реакция сульфохлорирования(одновременного воздейтвия хлора и диоксида серы на предельные углеводороды)
RH + SO2 + Cl2 = RSO2Cl + HCl.
Большей интенсивностью характеризуются гомогенные процессы в жидкой фазе, чем в газовой. Гомогенные процессы, как правило идут в кинетической области(тоесть общая скорость процесса, определяется скоростью химической реакции).
Вопрос
Выражение для скорости гомогенных химических реакций.
Скорость химической реакции, принято выражать количеством одного из реагентов, или продуктов, прореагировавших или образовавшихся в единицу времяни при единице реакционного пространства.
Под реакционным пространством в случае гомогенных реакций, понимают объём реактора, а в случае гетерогенных реакций, поверхность раздела фаз, на которой протекает процесс.
wy(омега итое) = +/- 1/V * dny/Dt(тау).
wy — скорость по компоненту y;
V - реакционный объём;
n — число моль компонента y;
t(тау) — время реакции.
Скорость реакции может быть измерена по любому веществу в реакции, она всегда положительна по этому, знак перед dny/dt, должен определятся по тому, является ли вещество реагентом(тогда производная отрицательна) или продуктом реакции, тогда dny/dt полижительна.
В случае, если реакция протекает при постоянном объёме, скорость определяется как изменение молярной концентрации в единицу времени.
Wy = +/-dny/V/dt = +/-dCy/dt.
Если в уравнении реакции присутствуют стехиометрические коэффициенты, то скорость реакции определяется по уравнению:
wy = +/-1/J * 1/V * dny/dt = +/- 1/J * dCy/Dt.
J - стехиометрический коэффициент у компонента y, по которому рассчитывется скорость реакции.
Вопрос
Химические процессы систем газ-твёрдое.
Адсорбция газа твёрдым телом, пиролиз твёрдого топлива, возгонка твёрдых материалов, обжиг твёрдых материалов.
Обжигом называют высокотемпературные химико-технологические процессы, с участием твёрдых и газообразных реагентов.
При обжиге могут происходить возгонка, пиролиз, диссоциация, частичное плавление, кальцинация.
Кальцинация — это один из видов разложения при обжиге, то есть удаление воды, связанной в виде гидратов, и диоксида углерода.
В зависимости от состава подаваемого на обжиг газа, и от типа протекающих реакций, обжиг делят на окислительный и восстановительный. Реакции могут протекать в твёрдой или газовой фазе. Оптимальные температуры процесса обжига зависят от природы реагентов и концентрации их, от давления и поверхности соприкосновения реагирующих фаз, интенсивности перемешивания, степени измельчённости твёрдой фазы.
Две модели процессов обжига.
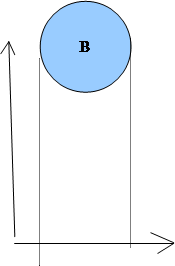
· Квазигомогенная модель.
А(г) + В(т) = R(г) + S(т).
Допустим, что при протекании этой реакции, внешние размеры твёрдой частицы не меняются.
Квазигомогенная модель предполагает, что гетерогенный процесс протекает одновременно в любой точке объёма твёрдой частицы. Это возможно, если газообразный реагент может достаточно свободно проникнуть внуть твёрдой фазы, то есть если частица твёрдого вещества пронизана большим количеством пор, а химическая реакция протекающая на поверхности этих пор достаточно медленная.
 |  | ||||
 | |||||
· Модель с непрореагировавшим ядром, или модель с фронтальным протканием реакции.
В этой модели предплогается, что реакция сначала протекает на поверхности тсела, при чём зона реакции постепенно проникает вглубь частицы, в результате чего, образуются продукты реакции. Твёрдые продукты реакции называются золой. Ядро остаётся непрореагировавшим. Процесс делится на стадии.
1. Диффузия исходного газообразного компонента через поверхность частицы.
2. Диффузия исходного газообразного компонента через слой золы.
3. Химическая реакция на поверхнотси ядра.
4. Диффузия газообразных продуктов реакции через слой золы.
5. Диффузия газообразных проудктов реакции в газовый объём.
W(омега) = к * F * дельтаС = 1 / (1/кг * 1/кз * 1/кт) * F * дельта С, где:
1/кг — сопротивление пограничной газовой плёнки;
кт — константа скоротси реакции отнесённая к единице твёрдой поверхности;
1/кз = Rч/2D — сопротивление слоя золы, при средней толшине равной половине радиуса частицы, где
D скорость диффузии газа сковозь слой золы.
 |
1- непрореагировавшее ядро.
2 — слой вещества где идёт реакция


































 3- слой золы, где концентрация исходного газа выше чем в потоке.
3- слой золы, где концентрация исходного газа выше чем в потоке.
Лимитирующую стадию определяют экспериментально изучая зависимости скорости реакции или выхода продукта, от темпаратуры, давления, потока и т.д..
Зная лимитурющу фазу можно оптимизировать процесс, если нужно.
| |||||||||||||||||
 | |||||||||||||||||
 | |||||||||||||||||
 | |||||||||||||||||
| |||||||||||||||||
 |  | ||||||||||||||||
 | |||||||||||||||||
 |
4Fe2S + 11O2 = 2Fe2O3 + 8SO2
 |
Вопрос
Аппаратное оформление процессов с Г/Т составом фаз.
1. Реактор с неподвижным слоем твёрдого вещества, возможны режимы прямотока и противотока, работает в режиме идеального вытеснения по обоим компонентам, политермический режим. Твёрдое вещество подаётся периодически порциями.
 | |||||
| |||||
 |
2. Противоточный реактор с подвижной твёрдой фазой
 |
Большинство некаталитических процессов в системе Г/Т основаны на химических реакциях, протекающих при высокой температуре. Апараты для выскотемпературных реакций называются печами.
Промышленная печь — это аппарат, в котором получается теплота, используемая для тепловой обработки твёрдых материалов в самой печи. Теплота в ней выделяется за счёт горения топлива, или протекания экзотермических реакций, или же за счёт превращения электрической энергии в тепловую. Особенность промышелнной печи состоит в том, что в ней сочетаются производящий аппарат и энергетическое устройство.
Полочная механическая печь.
 | |||
 |
В этой печи противоточный режим движения фаз, близок к вытесенению, политермический режим.
Барабанный реактор с вращающимся корпусом.
 |
Близок к вытесенению по газу, политермический режим.








 Реактор с механическим транспортом твёрдого вещества.
Реактор с механическим транспортом твёрдого вещества.
 | |||||||||||
 | |||||||||||
 |  | ||||||||||
 | |||||||||||
 | |||||||||||
Вопрос
|
|
|


