 |
При дегидратации спиртов и дегидрогалогенировании галогеналканов протон отщепляется преимущественно от наименее гидрогенизированного (имеющего меньшее число атомов водорода) атома углерода (1875г.).
|
|
|
|
Такое направление протекания этих реакций элиминирования объясняют повышенной термодинамической стабильностью образующегося олефина. Чем больше заместителей, тем больше возможностей для сверхсопряжения. Тем выше степень делокализации электронов, находящихся на π-связи. Соответственно выше термодинамическая стабильность. Стереоселективность определяется большей устойчивостью транс -изомера.
1. Дегидратация спиртов (элиминирование).
Отщепление воды от спирта проводят в газовой и жидкой фазах. В обоих случаях реакцию проводят при высокой температуре в присутствии водоотнимающего средства. В жидкой фазе используют серную или фосфорную кислоты, а в газовой фазе используют оксид фосфора (V), оксид алюминия, оксид тория или соли алюминия. Например:

Механизм элиминирования в жидкой фазе включает две стадии. На первой образуется эфир из кислоты и спирта и на второй стадии распад эфира приводит к образованию олефина:
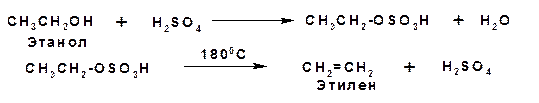
2. Дегидрогалогенироване галогеналканов.
Отщепление галогенводородов от галогеналканов проводят с использованием спиртового раствора едкого калия (КОН), реже используют NaОН:

3. Дегалогенироване вицинальных дигалогеналканов.
Олефины получают путем отщепления галогенов от дигалогенпроизводных с атомами галогена у соседних (или вицинальных) углеродных атомов. Элиминирование проводят в спиртовом или уксуснокислом растворе действием цинковой пыли:

4. Гидрирование ацетиленовых углеводородов и алкадиенов.
В некоторых случая по ходу синтеза легче получить ацетиленовый углеводород, чем алкен. Ацетиленовые углеводороды сравнительно легко превращаются в алкены частичным гидрированием. Водород к π-электронной системе без катализатора не присоединяется. В случае получения алкенов из алкинов используют два варианта каталитической реакции: в газовой фазе на катализаторах гидрирования (платина, палладий, никель)отравленных свинцом (PbO) и в жидкой фазе натрием в жидком аммиаке. При этом образуются алкены различной конфигурации:
|
|
|

Гидрирование 1,3-диенов приводит к образованию смеси, изомерных по положению двойной связи, алкенов:

Физические свойства.
При нормальных условиях первые четыре члена гомологического ряда этиленовых углеводородов – газы. Олефины с числом углеродных атомов от 5-ти до 17–ти - жидкости. Далее идут твердые тела.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с развевленной цепью. Терминальные олефины (с концевой двойной связью) кипят при более низкой температуре, чем их изомеры с расположением двойной связи внутри цепи. транс -Изомеры плавятся при более высокой температуре, чем цис -изомеры. цис -Изомеры обычно кипят при более высокой температуре, чем транс -изомеры.
Плотность олефинов меньше единицы, но больше, чем плотность соотвествующих парафинов. В гоологическом ряду плотность увеличивается.
Растворимость олефинов в воде мала, но выше, чем у парафинов.
Химические свойства.
Главным структурным элементом, определяющим химические свойства олефинов, является двойная связь, включающая одну σ- и одну π-связь. Утомы углерода двойной связи пребывают в состоянии sp2-гибридизации. Сравнение статических факторов, в частности длины и энергии связи показывает, что двойная связь короче и прочнее ординарной связи:

Энергия двойной связи 607.1 кДж/моль, что больше энергии ординарной связи – 349,6 кДж/моль. Однако две ординарные связи по энергии превосходят одну двойную связь на 92.1 кДж/моль. Поэтому двойная связь легко переходит в две ординарные σ-связи путем присоединения по месту двойной связи двух атомов или атомных групп.
|
|
|
Из этого следует, что для олефинов наиболее характерны реакции присоединения. Но некоторым видам олефинов свойственны реакции замещения. Наиболее легко замещается водород у α-углеродного атома по отношению к двойной связи. Так назыываемое аллильное положение. Образующийся, при гомолитическом разрыве связи радикал способен взаимодействовать с электронами π-связи, что обеспечивает его высокую стабильность и соответственно высокую реакционную способность.
Поскольку π-связь представляет собой облако отрицательного заряда расположенное над и под плоскостью молекулы, то олефины должны быть склонны к взаимодействию с частицами, несущими положительный заряд. Реагентами, несущими положительный заряд являются электрофилы.
5.1. Электрофильное присоединение
Электрофильным присоединением (АdЕ) называют реакции присоединения, в которых в скоростьлимитирующей стадии атакующей частицей является электрофил.
Механизм электрофильного присоединения включает три стадии.
Например, присоединение бромистого водорода к этилену с образованием бромистого этила в среде четыреххлористого углерода:

Механизм:
1. На первой стадии образуется так называемый π-комплекс:
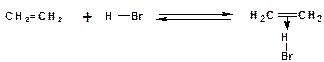
Особенностью π-комплекса является то, что атомы углерода двойной связи находятся в состоянии sp2-гибридизации.
2. Образование промежуточного карбкатиона. Эта стадия является медленной (скоростьлимитирующей):

На этой стадии один из атомов углерода двойной связи переходит в состояние sp3-гибридизации. Другой остается в состоянии sp2-гибридизации и приобретает вакантную р-орбиталь.
3. На третьей стадии бромид-ион, образовавшийся на второй стадии, быстро присоединяется к карбкатиону:

Аналогичный механизм можно привести для реакции электрофильного присоединения брома к этилену с образованием 1,2-дибромэтана в среде четыреххлористого углерода.
1. Образование π-комплекса:

2. Образование циклического бромониевого иона:

Циклический бромониевый ион более стабилен, чем открытый этил-катион. Причина такой стабильности в том, что в циклическом бромониевом ионе все атомы имеют по восемь электронов на внешнем электронном уровне. В то время ка в этил-катионе у атома углерода, несущего положительный заряд имеется только шесть электронов. Образование бромониевого иона связано с гетеролитическим разрывом связи Br- Br и отщеплением бромид-иона.
|
|
|
3. Присоединение бромид-иона к циклическому бромониевому иону:

Поскольку одна сторона исходного алкена экранирована в бромониевом ионе положительно заряженным атомом брома, то бромид-ион может атаковать бромониевый ион только с противоположной стороны. При этом трехчленный цикл раскрывается, а бромид-ион образует ковалентную связь с атомом углерода. Продуктом присоединения является вицинальный дибромид.
Доказательством представленного механизма, предусматривающего атаку бромониевого иона бромид-ионом с тыльной стороны, является образование транс -1,2-дибромциклогексана по реакции циклогексена с бромом:

Правило Марковникова.
Взаимодействие галогенводородов с несимметричными алкенам по механизму электрофильного присоединения приводит к образованию продуктов строго определенного строения. Так по реакции 2-метил-2-бутена с бромистым водородом преимущественно образуется 2-бром-2-метилбутан:

Строение, образующегося продукта в случае реакции электрофильного присоединения к несимметричным алкенам подчиняется правилу Марковникова:
При присоединении галогеноводорода к несимметричному алкену протон реагента преимущественно присоединяется к наиболее гидрогенизированному(имеющему большее число атомов водорода) атому углерода (1869г.).
Объяснение данному направлению хода реакции заключается в том, что образующиеся на второй стадии механизма электрофильного присоединения карбкатионы формируют ряд стабильности, аналогичный ряду стабильности радикалов:
Метил-катион <первичный <вторичный <третичный.
В соответствии с рядом стабильности продукт присоединения галогенид-иона к третичному углеродному атому будет более предпочтительным, чем присоединение ко вторичному.
|
|
|
По механизму электрофильного присоединения в соответствии с правилом Марковникова к олефинам присоединяются:
галогенводороды; галогены, вода, гипогалогенитные кислоты:

В случае присоединения гипогалогенитных кислот в роли электрофильной частицы выступает ион галоида (кроме фтора), поскольку электроотрицательность хлора, брома и йода меньше, чем у кислорода.
Радикальные реакции.
|
|
|


