 |
Радикальное присоединение.
|
|
|
|
Присоединение галогенов к двойной связи может протекать как по ионному (атака электрофильной частицей), так и по радикальному механизму.
При радикальном присоединении атомы галогенов,образующиеся в результате распада молекул под действием квантов света, присоединяются к наиболее доступному из атомов углерода с образованием наиболее стабильного из возможных радикалов:

Легче образуется и более стабилен радикал (1). В этом радикале неспаренный электрон сопряжен с пять связями С-Н. Для радикала (2) возможно сопряжение только с одной связью С-Н. Кроме того, первичный углеродный атом более доступен атакующей частице, чем вторичный. Радикал (1) далее реагирует с молекулой галогена с образованием продукта и генерацией нового радикала брома, что обеспечивает рост цепи радикального механизма:

В представленном механизме атакующей частицей является радикал брома. Если радикалы брома генерировать в условиях присоединения галогенводородов, то на первой стадии также будет происходить атака бромом, поскольку атом брома более устойчив, чем атом водорода. На этом принципе основано присоединение бромистого водорода к несимметричным алкенам по Карашу – против правила Марковникова. Стадия зарождения цепи в этом случае обеспечивается введением перекисей, что при записи уравнения реакции обозначается символом «ROOR» над стрелкой (формула четырехлористого углерода означает, что реакция протекает по ионному механизму, в соответствии с правилом Марковникова):
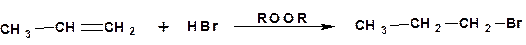
Объяснение этому факту дает механизм реакции. Оскольку пероксид легко распадается на два оксидных радикала, что составляет стадию зарождения цепи, то дальнейший рост цепи связан с образованием радикала (или атома) брома:
|
|
|

На следующей стадии радикал брома присоединяется к олефину. При этом возможно образование двух радикалов:
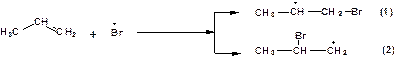
Из двух возможных радикалов (1) и (2) первый более устойчивый и быстрее образуется. Поэтому первый радикал способствует дальнейшему росту цепи:

Реакция протекает как радикально-цепной процесс при низких температурах (-800С)
Радикальное замещение.
Взаимодействие гомологов этилена с галогенами (хлор, бром) при высоких температурах, свыше 4000С, ведет только к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом в конечном продукте сохраняется:

Реакция протекает как цепной процесс радикального замещения (SR). Высокая температура способствует гомолизу молекул хлора и образованию радикалов.
Гидрирование.
Алкены непосредственно молекулярный водород не присоединяют, Эту реакцию можно провести только в присуствии гетерогенных катализаторов, например, платина, палладий, никель, или гомогенных, например, комплексная соль родия. Обычно в лабораториях и в промышленности для присоединения водорода по двойной связи используют гетерогенные катализаторы:

Термодинамически эта реакция весьма выгодна:
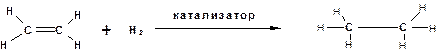
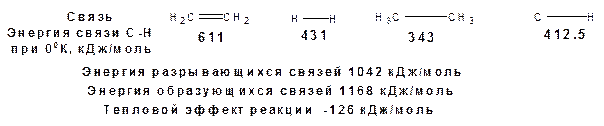
Поскольку при гидрировании с использованием гетерогенного катализатора необходимо адсорбировать олефин на поверхности катализатора по двойной связи. Соответственно олефины гидрируются тем легче, чем меньше заместителей у двойной связи – правило Лебедева.
Окисление.
Существует два основных направления (типа) в окислении олефинов:
1. с сохранением углеродного скелета – это эпоксидирование и гидроксилирование;
2. с разрывом двойной углерод – углеродной связи – это озонолиз и исчерпывающее окисление алкенов.
В зависимости от типа используют различные окислители.
|
|
|
Эпоксидирование
Эпоксидированием называется образование эпоксида – трехчленного циклического простого эфира. Кислородом воздуха в присуствии серебрянного катализатора этилен эпоксидируется в окись этилена:
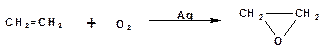
Остальные олефины эпоксидируются действием пероксикарбоновых кислот или просто надкислот (реакция Прилежаева). Пероксикарбоновые кислоты содержат перекисную структуру «О-О», которая отдает один атом кислорода двойной связи:

Гидроксилирование
Разбавленный (5-10%) раствор перманганата калия (реакция Вагнера) с олефинами образуют цис -гликоли или цис -1,2-диол:

|
|
|


