 |
Функции атомов элементов в ОВР
|
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
Основные определения
|
Например, реакция
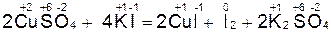
является окислительно-восстановительной, так как изменяется степень окисления атомов меди и йода.
|
Степень окисления при необходимости указывают арабской цифрой над символом элемента в формуле или римской цифрой в названии вещества.
Для расчета степеней окисления элементов используют следующие правила:
v степень окисления атомов в простых веществах равна нулю 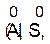
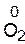 и др.);
и др.);
v степень окисления атомов металлов главной подгруппы первой группы в соединениях равна (+1), главной подгруппы второй группы (+2);
v степень окисления кислорода в соединениях равна (-2), за редкими исключениями (например, пероксиды  );
);
v степень окисления водорода в большинстве соединений (+1), за некоторыми исключениями (в гидридах металлов (–1), например,  );
);
v алгебраическая сумма степеней окисления атомов в молекуле равна нулю, а в ионе – его заряду.
Для определения степеней окисления атомов элементов (х) можно составить простейшие алгебраические уравнения.
S O2 х + 2·(- 2) = 0 х = +4
K2 S O4 2·(+1) + х + 4·(- 2) = 0 х = +6
Cr 2O72– 2х + 7·(- 2)= - 2 х = +6
Большинство элементов способно проявлять несколько степеней окисления.
Высшая степень окисления атомов элементов, как правило, равна номеру группы (исключение – кислород, фтор,элементы VIII группы и побочной подгруппы I группы).
|
|
|
Низшая степень окисления атомов металлов равна нулю, атомов неметаллов – суммарному заряду электронов, необходимых для достройки последнего энергетического подуровня – (№ группы – 8).
В частности, для азота известны соединения, в которых атом азота проявляет степени окисления от -3 - низшей до +5 - высшей:
 ,
,
степени окисления -2, -1, 0, +1, +2, +3, +4 называют промежуточными.
| Окисление – отдача электронов и повышение степени окисления атомов элементов. Восстановление – присоединение электронов и понижение степени окисления атомов элементов. |
| Окислитель – атом элемента, степень окисления которого понижается в результате принятия электронов. Окислитель восстанавливается. Восстановитель – атом элемента, степень окисления которого повышается в результате отдачи электронов. Восстановитель окисляется. |
Атомы элементов входят в состав веществ или ионов, эти вещества или ионы соответственно тоже называют окислителями или восстановителями. Например, в реакции
Zn + CuSO4 = ZnSO4 + Cu,
Zn + Cu2+ = Zn2+ + Cu,
восстановитель – атом цинка – превращается в ион Zn2+, окислитель – ион Cu2+ – превращается в нейтральный атом. Иными словами – цинк (вещество) – восстановитель, окисляется, а сульфат меди (II) CuSO4 – окислитель, восстанавливается до меди металлической.
В каждой ОВР участвуют две окислительно-восстановительные пары: окислитель и продукт его восстановления (Cu2+ - Cu), восстановитель и продукт его окисления (Zn - Zn2+).
Функции атомов элементов в ОВР
 По роли атомов элементов в ОВР можно выделить три группы веществ.
По роли атомов элементов в ОВР можно выделить три группы веществ.
из простых веществ – кислород и фтор;
в составе сложных веществ – атомы элементов в высшей степени окисления.
Примеры:  и др.
и др.

атомы элементов в низшей степени окисления в составе простых и сложных веществ.
 Примеры:
Примеры: 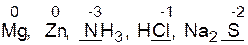 и др.
и др.
атомы элементов в промежуточной степени окисления в составе простых и сложных веществ.
|
|
|
Примеры:  и др.
и др.
Составление уравнений окислительно-восстановительных реакций
Составление уравнений ОВР основано на законах сохранения числа атомов и заряда. Для подбора коэффициентов при составлении уравнений окислительно-восстановительных реакций необходимо соблюдение:
v материального баланса (число атомов каждого элемента в левой и правой частях уравнения должно быть одинаково);
v электронного баланса (число электронов, отданных восстановителем, должно быть равно количеству электронов, принятых окислителем).
|
|
|


