 |
Составление уравнений ОВР методом электронно-ионного баланса
|
|
|
|
Последовательность составления уравнений рассмотрим на конкретных примерах ОВР с заданными продуктами.
 Составление уравнений реакций, протекающих в кислой среде
Составление уравнений реакций, протекающих в кислой среде
Допишите методом электронно-ионного баланса уравнение реакции, молекулярно-ионная схема которой
КIO3 + Na2SO3 + Н2SO4 ® I2 + SO42– +....
Решение.
1. Рассчитывают степени окисления атомов тех элементов, которые ее изменяют, определяют окислитель, восстановитель и среду:
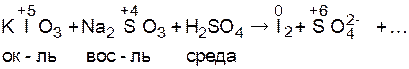
2. Составляют ионную схему реакции в соответствии с правилом составления ионных уравнений (сильные растворимые электролиты записывают в виде ионов, остальные вещества – в молекулярной форме)
 К+ + IO3¯ + 2Na+ +SO32– + 2Н+ + SO42– ® I2 + SO42– +,
К+ + IO3¯ + 2Na+ +SO32– + 2Н+ + SO42– ® I2 + SO42– +,
выделяют окислительно-восстановительные пары
IO3– ® I2
SO32– ® SO42–.
3. Составляют уравнения полуреакций.
Вначале уравнивают число атомов элементов, изменяющих степень окисления:
2IO3– ® I2
SO32– ® SO42–,
а затем – число атомов кислорода и водорода. В кислой среде для этого добавляют в ту часть уравнений полуреакций, где недостает n атомов кислорода, n молекул воды, а в противоположную часть – 2 n ионов водорода:
2IO3¯ + 12Н + ® I2 + 6Н2О
SO32– + Н2О ® SO42– + 2Н+.
По изменению степеней окисления определяют число отданных и принятых электронов, а затем дописывают уравнения полуреакций:
2IO3¯ + 12Н + + 10ē = I2 + 6Н2О
SO32– + Н2О - 2ē = SO42– + 2Н +.
4. Определяют множители для уравнивания числа отданных и принятых электронов, после чего суммируют уравнения полуреакций с учетом найденных множителей:


 2IO3¯ + 12Н + + 10ē = I2 + 6Н2О 2 1
2IO3¯ + 12Н + + 10ē = I2 + 6Н2О 2 1
 SO32– + Н2О - 2ē = SO42– + 2Н + 10 5
SO32– + Н2О - 2ē = SO42– + 2Н + 10 5
2IO3¯ + 12Н + + 5SO32– + 5Н2О = I2 + 6Н2О + 5SO42– + 10Н+.
5. Приводят подобные – сокращают одинаковые частицы в левой и правой части уравнения.
|
|
|
2IO3¯ + 12Н + + 5SO32– + 5Н2О = I2 + 6Н2О + 5SO42– + 10Н +
2IO3¯ + 2Н+ + 5SO32– ® I2 + Н2О + 5SO42–.
6. Дописывают к ионам левой части противоионы (исходя из состава исходных веществ), а затем добавляют их в правую часть уравнения, так как противоионы в ходе ОВР не изменяются. В результате получают полное ионное уравнение, в котором катионы и анионы сгруппированы с учетом формул исходных веществ и продуктов реакции.





 2IO3¯ + 2Н + + 5SO32– = I2 + Н2О + 5SO42–
2IO3¯ + 2Н + + 5SO32– = I2 + Н2О + 5SO42–
 2K+ SO42– 10Na+ 10Na+ 2K+ SO42-
2K+ SO42– 10Na+ 10Na+ 2K+ SO42-
7. Составляют молекулярное уравнение реакции:
2КIO3 + 5Na2SO3 + Н2SO4 = I2 + H2O + 5Na2SO4 + K2SO4.
Правильность расстановки коэффициентов можно проверить по балансу атомов кислорода: слева и справа содержится одинаковое число атомов (25).
 Составление уравнений реакций, протекающих в щелочной среде
Составление уравнений реакций, протекающих в щелочной среде
Допишите методом электронно-ионного баланса уравнение реакции, молекулярно-ионная схема которой
Cr2O3 + KClO3 + KOH ® CrO42– + Cl¯.+...
Решение.
1. Рассчитывают степени окисления атомов тех элементов, которые ее изменяют, определяют окислитель, восстановитель и среду:
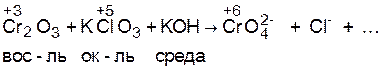
2. Составляют ионную схему реакции
 Cr2O3 + K+ + ClO3¯ + K+ + OH¯® CrO42– + Cl¯ +...,
Cr2O3 + K+ + ClO3¯ + K+ + OH¯® CrO42– + Cl¯ +...,
выделяют окислительно-восстановительные пары
Cr2O3 ® CrO42–
ClO3¯ ® Cl¯.
3. Составляют уравнения полуреакций.
Уравнивают число атомов хрома:
Cr2O3 ® 2CrO42–
ClO3¯ ® Cl¯,
затем – число атомов кислорода и водорода. В щелочной среде для этого добавляют в ту часть уравнений полуреакций, где недостает n атомов кислорода, 2 n гидроксид-ионов, а в противоположную часть – n молекул H2O:
Cr2O3 + 10OH¯® 2CrO42– + 5H2O
ClO3¯ + 3H2O ® Cl¯ + 6OH¯.
По изменению степеней окисления определяют число отданных и принятых электронов, после чего дописывают уравнения полуреакций:
Cr2O3 + 10OH¯ – 6ē = 2CrO42– + 5H2O
ClO3¯ + 3H2O + 6ē = Cl¯ + 6OH¯.
4. Суммируют уравнения полуреакций (в данном примере число отданных и принятых электронов одинаково):
Cr2O3 + 10OH¯ – 6ē = 2CrO42– + 5H2O
 ClO3¯ + 3H2O + 6ē = Cl¯ + 6OH¯
ClO3¯ + 3H2O + 6ē = Cl¯ + 6OH¯
|
|
|
Cr2O3 + 10OH¯ + ClO3¯ + 3H2O = 2CrO42– + 5H2O + Cl¯ + 6OH¯
5. Приводят подобные и получают краткое ионное уравнение реакции:
Cr2O3 + 10OH¯ + ClO3¯ + 3H2O = 2CrO42– + 5H2O + Cl¯ + 6OH¯
Cr2O3 + ClO3¯ + 4OH- = 2CrO42– + 2H2O + Cl¯.
6. Дописывают в левую часть противоионы, а затем те же противоионы добавляют к ионам правой части, группируя их с учетом формул веществ:



 Cr2O3 + ClO3¯ + 4OH¯ = 2CrO42– + 2H2O + Cl¯.
Cr2O3 + ClO3¯ + 4OH¯ = 2CrO42– + 2H2O + Cl¯.
K+ 4K+ 4K+ K+
7. Составляют молекулярное уравнение реакции:
Cr2O3 + KClO3 + 4KOH = 2K2CrO4 + 2H2O + KCl.
Проверка баланса атомов кислорода

 3 + 3 + 4 = 2·4 + 2
3 + 3 + 4 = 2·4 + 2
10 10
подтверждает правильность расстановки коэффициентов.
|
|
|


