 |
Автоклавно-окислительное разложение пирротинового полупродукта
|
|
|
|
Состав полупродукта: 2% Ni; 2% Сu; 0,1% Со; 49% Fe; 29% S, 15,0% окислы пустой породы, в том числе 5% SiO2, 7% А12О3, 2% MgO, 1% СаО. Минеральный состав: пентландит, халькопирит, кубанит (мало), пирротин гексагональный, магнетит, силикаты. Требуется определить расход кислорода технологического, выход серы элементарной, состав богатого первичного автоклавного никелевого концентрата. Суммируем данные химического анализа: 2+2+49+29+14=97,0%. Как видим, недостает 3%. Предполагаем, что это кислород магнетита и кристаллизационная вода. Рассчитываем рациональный состав концентрата. Количество магнетита определяем, предварительно считая, что все 3 кг, недостающие до 100 кг, связаны в нем в виде кислорода. Находим количество магнетита: 3•232/64=10,88 кг; железа в нем 7,88 кг. Определяем количество халькопирита: меди в нем 2 кг; серы по составу минерала столько же. Железа в нем 2/64•56=1,75 кг. Всего халькопирита 2+2+1,75=5,75 кг. Остатки серы и железа и никель распределяем между пентландитом и никельсодержащим пирротином, полагая, что в пирротине содержится около 1,0% Ni. Остаток железа равен 49,0–7,88–1,75=39,37 кг; остаток серы соответственно 29,0–2,0=27,0 кг.
Пусть никеля в пентландите будет х кг и в пирротине 2–х кг. Тогда железа в пентландите будет х•56/59, а в пирротине 39,37–х•56/59= а.
Находим количество пирротина: а •(12•56+13•32)/(12•56)=34 а /21.
Здесь 12 и 13 – числа атомов железа и серы в молекуле пирротина (см. таблицу минералов),
56 и 32 – их атомные массы.
В пирротине никеля содержится (34 а •1/21)•100 кг.
Составляем уравнение [(34 а •1)/21]•100=2–х.
Решая его, находим, что х=1,4 кг (0,6 кг Ni находится в пирротине). Железа с ним 1,40•56/59=1,33 кг. Серы в пентландите 1,40/59•2•32•8/9=1,37 кг. Железа в пирротине 39,37–1,33=38,04 кг.
Количество пирротина равно 61,62 кг. В нем серы (61,62•13•32)/(12•56+13•32)=23,56 кг. Серы, связанной с никелем, растворенным в пирротине, будет 0,6•32/59=0,32 кг и сульфида никеля 0,6+0,32=0,92 кг. Всего серы в пентландите и пирротине 23,56+1,37+0,32=25,25 кг. Остаток серы 27–25,25=1,75 кг.
|
|
|
Это количество серы связывает железа 1,75•56/32=3,07 кг. Поэтому уменьшаем количество железа в магнетите: 7,88–3,07=4,81 кг.
Всего магнетита будет 4,81•232/168=6,72 кг, кислорода в нем 1,91 кг.
Дополнительное количество пирротина равно 1,75+3,07=4,82 кг.
Всего чистого пирротина будет 61,62+4,82=66,44 кг, а никельсодержащего – соответственно 66,44+0,92=67,36 кг.
Результаты расчета сводим в таблицу 60.
ТАБЛИЦА 60 Минеральный состав полупродукта, %
| Минералы | Ni | Cu | Fe | S | Порода | Всего |
| Пентландит Халькопирит Пирротин Магнетит Порода | 1,40 – 0,60 – – | – 2,00 – – – | 1,33 1,75 41,11 4,81 – | 1,37 2,00 25,65 – – | – – – 1,91 | 4,10 5,75 67,37 6,72 15,00 |
| Итого | 2,00 | 2,00 | 49,00 | 29,02 | 16,91 | 98,93 |
Видно, что в составе полупродукта имеются неопределенные элементы и неучтенный кобальт в количестве около 1%. Химический анализ можно считать достаточно надежным. Наличие, кубанита расчетом не установлено.
Расчет расхода кислорода. Разложение пирротинового полупродукта производят в автоклавах. На 100 кг концентрата подают 100 кг воды. Во время разложения образуется гидрат окиси железа (с некоторым содержанием сульфатной серы), элементарная сера, сульфаты никеля, меди, алюминия, магния, серная кислота и остаток сульфидов и пустой породы.
Долю пирротина, пентландита и других минералов, вступающую в реакцию, следует брать на основании опытных работ после консультации с руководителем проекта. В приводимом расчете приняты следующие данные, действительные для одного из опытнопромышленных режимов:
Разложение пирротина, % 92
Переход в раствор, %:
железа 6•(49•0,06)=2,94 кг;
никеля 50•(2•0,5)=1,0 кг;
меди 15•(2•0,15)=0,3 кг;
магния 50•(2•0,5)=1,0 кг;
алюминия 25•(7•0,25)=1,75 кг.
|
|
|
Образование раствора H2SO4, г/л 10–12
Записываем основную реакцию:
Fe12S13 + 9О2 + 18Н2О = 6Fe2O3•3H2O + 13S.
В осадке гидрата окиси железа обычно содержится около 3% сульфатной серы. В перерасчете на SO4 это составляет 9%. Этим путем теряется сера и увеличивается расход кислорода.
При мольной массе осадка гидрата железа 1284 единиц в нем будет серы* 1284•3/100=38,5 единиц и кислорода 77 единиц или округленно 40 и 80 единиц, что составляет 2,5 моля кислорода и 1,25 моля серы. Итого расход кислорода на 1 моль пирротина составит 9+2,5=11,5 молей. Образуется серы 13–1,25=11,75 молей. В нашем случае на 66,42 кг чистого пирротина или на (66,42•1000)/(12•56+32•32)=61 моль; образуется и расходуется: кислорода 61•0,92•11,5=645,4 моля; гидрата железа 61•0,92•6=336,7 моля (72,06 кг); в нем SO4 61,0•1,25•32•3=7,32 кг; серы элементарной 61•0,92•11,75=659,4 моля; осадок сульфида никеля (остается) 10,1 моля. Остаток пирротина 61•0,08=4,88 моля. Из пентландита и пирротина в раствор переходит по условию 1 кг или 50% Ni; или 71,5% от имеющихся в пентландите 1,4 кг.
* Расчет в данном примере приведен в молях, что иногда представляет интерес для реакций с участием газов.
Записываем реакции
(Ni, Fe)9S8 + 10О2 = 2NiSO4 + Fe2(SO4)3 + (Ni, Fe)5S3.
Ha 1 моль пентландита расходуется 10 молей кислорода. В нашем случае на 4,1 кг расходуется 10•4,1•1000•0,715/(59•4,5+56•4,5+32•8)=38,32 моля. В знаменателе подсчитана мольная масса пентландита (Ni, Fe)9S8 для типичного случая, когда число грамм-атомов железа равно числу грамм-атомов никеля, т.е. 9/2=по 4,5 г-атома каждого. Остаток пентландита 4,1–1,0–1•56/59–1•32/59–1•56•48/(59•56)=0,8 кг. Медь из халькопирита растворяется на 15%, т.е. 0,3 кг. Соответственно растворяется 0,26 кг железа и 0,3 кг серы. Записываем реакцию
CuFeS2 + 5О2 = CuSO4 + 1/2Fe2(SO4)3.
Расходуется кислорода (5•5,75•1000•0,15)/(64+56+64)=23,75 молей; остаток халькопирита 5,75–0,3–0,26–0,3=4,89 кг. Таким образом, растворилось железа: из пентландита 1•56/59=0,95 кг, из халькопирита 0,26 кг, всего 1,21 кг с расходом серной кислоты 98,1/56•1,21=2,12 кг, или 21,2 моля.
По условию растворяется около 6% Fe, т.е 49•0,06=2,94 кг. Следовательно, в образующейся серной кислоте растворяется еще 2,94–1,21=1,73 кг железа.
Растворение происходит по реакции
Fe2O3•3H2O + 3H2SO4 = Fe2(SO4)3 + 6Н2О.
Расход серной кислоты составляет 1,73/112•3•1000=46,2 моля, а расход гидрата (1730/112)•214/1000=3,3 кг. Всего образовалось сульфата окиси железа (2940•400)/(112•1000)=10,50 кг. Рассчитаем расход серной кислоты в молях на растворение глинозема и окиси магния. Растворение глинозема:
|
|
|
А12О3 + 3H2SO4 = A12(SO4)3 + 3H2O;
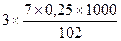 =51,47 моля.
=51,47 моля.
Образуется сульфата алюминия 1750+ 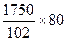 =5,87 кг.
=5,87 кг.
Растворение окиси магния:
MgO + H2SO4 = MgSO4 + Н2О;
(2•0,5•1000•1)/40=25 молей.
Образуется сульфата магния 1,0+2,0=3,0 кг.
Подсчитаем количество свободной кислоты в растворе. По условию имеем в растворе кислоты 10 г/л. Объем раствора 100 л. Кислоты в нем 100•10/98=10 молей, или 1,0 кг. Всего израсходовано серной кислоты 46,2+51,47+25,0+10=132,7 моля.
Эта серная кислота образовалась в результате окисления серы:
S + 1,5О2 = SО3.
Следовательно, расход серы и кислорода в соответствии с этой реакцией составил: серы 132,7 г-атома (1 г-атом на 1 моль кислоты), кислорода 131,1•1,5=199,0 молей. В итоге имеем следующий расход кислорода: 645,4+38,32+23,75+199,0=906,5 моля, или 906,5•22,4/1000=20,80 м3. С учетом использования на 95% и содержания кислорода в технологическом газе 96% расход его будет равен 20,80/(0,95•0,96)=22,9 м3. Выход элементарной серы составляет 659,4–132,7=526,7 моля; т.е. 526,7•32=16,86 кг, или 16,86/29,0•100=58,1%, Определим технологический выход и состав первичного сульфидного богатого концентрата (без учета потерь и механически увлекаемых примесей)*. В его состав входят остатки, г:
Пирротина 4,9•1088=5322
Сульфида никеля 10,1•91=919
Халькопирита 4890
Пентландита 800
* Остаток пустой породы отделяется от концентрата вместе с осадком гидрата железа на операции сваривания.
Состав полученного остатка приведен в таблице 61.
ТАБЛИЦА 61 Состав автоклавного концентрата, г
| Остаток | Ni | Cu | Fe | S | Всего |
| Пирротина Сульфида никеля и пентландита Халькопирита | – – | – – | |||
| Итого, г | |||||
| Итого, % | 8,38 | 14,24 | 43,58 | 33,80 |
Практически этот концентрат выделяется вместе с элементарной серой в гранулах. Гранулы подвергаются разварке. Растворенные цветные металлы направляются на доосаждение (или сорбцию) серой и губчатым железом. Сульфидный осадок флотируют и полученный концентрат после фильтрации присоединяют к первичному концентрату, а пульпу гидрата окиси железа направляют на нейтрализацию и затем в отвал. После операции доосаждения растворившихся никеля и меди и флотации суммарный концентрат несколько обогатится никелем. В концентрате будут содержаться примеси 1–5% гидрата железа и остатка породы. Результаты расчета материального баланса автоклавно-окислительного разложения пирротинового полупродукта приведены ниже, кг:
|
|
|
| Задано | Получено | ||
| Полупродукт Вода Кислород Азот | 100,0 100,0 31,5 1,1 | Магнетит Концентрат Сера Остаток породы Соли Fe, Al и Mg Соли Cu и Ni Осадок гидрата Кислота в осадке Кислота свободная Кислород и азот Прочие Вода Невязка | 6,7 11,9 16,9 12,3 19,4 3,5 68,7 6,2 1,0 2,3 1,1 82,4 0,2 |
| Итого | 232,6 | Итого | 232,6 |
Глава IV
|
|
|


