 |
Поглощение в УФ- и видимой областях.
|
|
|
|
Спектры и строение молекул
Электрические, оптические, магнитные и другие свойства молекул связаны с волновыми функциями и энергиями различных состояний молекул. Информацию о состояниях молекул и вероятности перехода между ними дают молекулярные спектры.
Частоты колебаний в спектрах определяются массами атомов, их расположением и динамикой межатомных взаимодействий. Частоты в спектрах зависят от моментов инерции молекул, определение которых с спектроскопических данных позволяет получить точные значения межатомных расстояний в молекуле. Общее число линий и полос в колебательном спектре молекулы зависит от её симметрии.
Электронные переходы в молекулах характеризуют структуру их электронных оболочек и состояние химических связей. Спектры молекул, которые имеют большее количество связей, характеризуются длинноволновыми полосами поглощения, попадающими в видимую область. Вещества, которые построены из таких молекул, характеризуются окраской; к таким веществам относятся все органические красители.
Молекулярные спектры
Среди физических методов исследования молекул особую роль играет изучение молекулярных спектров. Молекулярные спектры называют полосатыми, так как они достоят не из линий (как атомные спектры), а из обладающих сложной структурой полос.
Сложность молекулярных спектров определяется тем, что энергия молекул складывается из электронной, колебательной и вращательной.
Квант поглощаемой (или испускаемой) лучистой энергии определяется, вообще говоря, изменением этих видов энергии. Изменение только вращательной энергии (при постоянной колебательной и электронной) имеет место в так называемом вращательном или ротационном спектре молекул. Вследствие того, что величина кванта вращения мала, вращательные спектры лежат в инфракрасной части спектра. Так как испускание или поглощение света возможно лишь в случае периодического изменения дипольного момента, то вращательные спектры имеют лишь полярные молекулы.
|
|
|
27. Спектроскопи́я — разделы физики и аналитической химии, посвящённые изучению спектров взаимодействия излучения (в том числе,электромагнитного излучения, акустических волн и др.) с веществом. В физике спектроскопические методы используются для изучения всевозможных свойств этих взаимодействий. В аналитической химии — для обнаружения и определения веществ при помощи измерения их характеристических спектров, то есть методами спектрометрии. К существенным преимуществам спектроскопии можно отнести возможность диагностики in situ, то есть непосредственно в «среде обитания» объекта, бесконтактно, дистанционно, без какой-либо специальной подготовки объекта
Задачи спектроскопии
Прямая задача спектроскопии — предсказание вида спектра вещества исходя из знаний о его строении, составе и прочем.
Обратная задача спектроскопии — определение характеристик вещества (не являющихся непосредственно наблюдаемыми величинами) по свойствам его спектров (которые наблюдаются непосредственно и напрямую зависят как от определяемых характеристик, так и от внешних факторов).
[править]Виды спектроскопии
По объектам исследования можно выделить следующие виды спектроскопии: атомная спектроскопия, молекулярная спектроскопия, масс-спектроскопия, ядерная спектроскопия и другие.
По типу излучения, которое используется в спектроскопии для возбуждения взаимодействия, а также по типу регистрируемого излучения, её можно разделить на оптическую спектроскопию, рентгеновскую спектроскопию, фотоэлектронную спектроскопию, Мёссбауэровскую спектроскопию, масс-спектроскопию, спектроскопию с использованиемрадиоизлучения и т. д.
|
|
|
СПЕКТРОСКОПИЯ (от лат. spectrum-образ, представление и греч. skopeo-смотрю), раздел физики, изучающий спектры электромагн. излучения. Спектры возникают при переходах между уровнями энергии в атомах, молекулах и образованных из них макроскопич. системах. Различают спектры испускания (эмиссионные), поглощения (абсорбционные), отражения, рассеяния и люминесценции, к-рые изучают соответствующие виды спектроскопии (см., напр., Абсорбционная спектроскопия, Комбинационного рассеяния спектроскопия, Спектральный анализ, Спектроскопия отражения). В зависимости от природы объекта исследования выделяют атомную и молекулярную спектроскопию, а также спектроскопию в-ва в конденсир. состоянии, включая спектроскопию кристаллов (см. Атомные спектры, Молекулярные спектры). В соответствии с видами движения вмолекуле молекулярную спектроскопию делят на электронную, колебательную и вращательную (см. Электронные спектры, Колебательные спектры,Вращательные спектры). Аналогично различают электронную и колебательную спектроскопию кристаллов.
По диапазону длин волн (или частот) электромагн. излучения выделяют радиоспектроскопию, микроволновую спектроскопию, оптическую спектроскопию (см. Инфракрасная спектроскопия, Молекулярная оптическая спектроскопия, Ультрафиолетовая спектроскопия), рентгеновскую спектроскопию и гамма-спектроскопию (см. Мёссбауэровская спектроскопия, Гамма-абсорбционный анализ). Оптическую спектроскопию на практике иногда отождествляют со спектрофотометрией. В каждом разделе спектроскопии используются свои приборы для получения, регистрации и измерения спектров. В соответствии с различием конкретных эксперим. методов выделяют спец. разделы спектроскопии, напр. Фурье-спектроскопия, лазерная спектроскопия.
Систематич. изучение спектров началось во 2-й пол. 19 в. В 1859 Г. Р. Кирхгоф сформулировал принципы спектрального анализа. Н. Бор в 1913 объяснил закономерности в расположении спектральных линий. Изучение спектров атомов послужило основой создания квантовой механики. По спектрам были открыты неск. хим. элементов.
|
|
|
Методы спектроскопии используют для исследования уровней энергии атомов, молекул и образованных из них макроскопич. систем, изучения строения и св-в хим. соединений, для проведения качеств. и количеств. анализа в-в (см. Атомно-абсорбционный анализ, Атомно-флуоресцентный анализ, Люминесцентный анализ, Фотометрический анализ, Фотометрия пламени эмиссионная, Фотоэлектронная спектроскопия).
Спектры поглощения. У подавляющего числа известных многоатомных молекул электронные спектры поглощения определяются переходами из основного синглетного состояния S0 в возбужденные синглетные состояния Si (т. наз. S0  Si-спектры). При комнатной и более низких т-рах почти все молекулы находятся на нулевом колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат. уровня S0-состояния на разл. колебательные уровни Si-состояний (рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются, в электронных спектрах поглощения обычно не наблюдаются полосы, связанные с переходами S1
Si-спектры). При комнатной и более низких т-рах почти все молекулы находятся на нулевом колебат. уровне. Полосы поглощения обусловлены переходами с нулевого колебат. уровня S0-состояния на разл. колебательные уровни Si-состояний (рис. 2). Ввиду того, что возбужденные состояния быстро дезактивируются, в электронных спектрах поглощения обычно не наблюдаются полосы, связанные с переходами S1  Si или T1
Si или T1  Тi. Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров, позволяющих создать на короткое время заметную заселенность T1- и S1-состояний. Получаемые при этом спектры T1
Тi. Их удается зарегистрировать Лишь с помощью импульсных ламп или лазеров, позволяющих создать на короткое время заметную заселенность T1- и S1-состояний. Получаемые при этом спектры T1  Ti- и S1
Ti- и S1  Si -поглощения наз. спектрами наведенного поглощения.
Si -поглощения наз. спектрами наведенного поглощения.
Поглощение света отдельно взятой молекулой - анизотропный процесс. Дихроизм поглощения для кристаллов, ориентированных пленок, жидких кристаллов принято характеризовать величиной d:

где 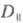 и
и 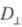 - оптич. плотности для линейно поляризованного света определенной длины волны с плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость
- оптич. плотности для линейно поляризованного света определенной длины волны с плоскостью поляризации, соотв. параллельной и перпендикулярной выделенному в в-ве направлению, напр. оси ориентации (растяжения) пленки. Зависимость  наз. спектрами дихроизма.
наз. спектрами дихроизма.

Рис. 2. Электронные спектры испускания (I) и поглощения (II). Указаны времена жизни ( с) и типы (S0, S1, S2, T1) энергетач. состояний. Е - энергия;
с) и типы (S0, S1, S2, T1) энергетач. состояний. Е - энергия;  - длины волн; v - волновые числа линий поглощения или испускания.
- длины волн; v - волновые числа линий поглощения или испускания.
Весьма часто в многоатомных молекулах можно выделить сравнительно небольшие фрагменты, наз. хромофорными группами (хромофорами), к-рые в осн. ответственны за поглощение излучения. Электронное возбуждение при этом определяется гл. обр. изменением электронного распределения именно в локальных областях этих групп.
Поглощение света в-вом характеризуют обычно пропусканием, равным отношению интенсивностей прошедшего и падающего пучков, либо коэф. экстинкции, связанным с логарифмом пропускания (см. Абсорбционная спектроскопия). Полосам поглощения в электронных спектрах соответствуют молярные коэф. экстинкции от 103 до 106, тогда как в случае, напр., запрещенных по симметрии электронных переходов эти коэф. обычно не превышают 10 - 102.
|
|
|
7.. Типы спектров поглощения
Молекулярная абсорбционная спектроскопия наблюдает изменения энергетического состояния молекул при поглощении излучения. Из возможных видов движения молекулы - вращения частицы как целого, колебания ядер и возбуждения электронов - особенно большое аналитическое значение имеют два последних.
Вращательные спектры
Вращение молекул проявляется у веществ лишь в газообразном состоянии, в конденсированных состояниях (жидком и твердом) вращение затруднено. Вращение молекул газа может вызвать излучение с частотой 1011 - 1013 Гц (волновое число  ~10 - 102 cм -1); энергия квантов в этой области спектра равна 1,2 кДж / моль и меньше (по другим сведениям она составляет 0,01 - 0,4 кДж / моль). Это значение соизмеримо с энергией теплового движения. Вращательные спектры наблюдают при помощи микроволновой техники (тяжелые молекулы) или методов инфракрасной спектроскопии (более легкие молекулы). Для аналитических целей они имеют небольшое значение, их применяют главным образом для исследования строения молекул.
~10 - 102 cм -1); энергия квантов в этой области спектра равна 1,2 кДж / моль и меньше (по другим сведениям она составляет 0,01 - 0,4 кДж / моль). Это значение соизмеримо с энергией теплового движения. Вращательные спектры наблюдают при помощи микроволновой техники (тяжелые молекулы) или методов инфракрасной спектроскопии (более легкие молекулы). Для аналитических целей они имеют небольшое значение, их применяют главным образом для исследования строения молекул.
Колебательные спектры
Спектры, соответствующие колебательным переходам, наблюдают в инфракрасной области ( ~ 102
~ 102  5· 103 см -1), что соответствует энергии квантов от 3 до 60 кДж / моль (согласно другим данным, 0,4
5· 103 см -1), что соответствует энергии квантов от 3 до 60 кДж / моль (согласно другим данным, 0,4  15 кДж / моль), поэтому при обычной температуре энергетическое состояние молекулы характеризуется основным колебательным уровнем. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
15 кДж / моль), поэтому при обычной температуре энергетическое состояние молекулы характеризуется основным колебательным уровнем. Количество возможных колебаний зависит от числа атомов в молекуле; число наблюдаемых колебаний обусловлено симметрией молекул.
КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ, мол. спектры, обусловленные квантовыми переходами между колебат. уровнями энергии молекул. Экспериментально наблюдаются как ИК спектры поглощения и спектры комбинац. рассеяния (КР); диапазон волновых чисел ~10-4000 см-1 (частоты колебат. переходов 3.1011-1014 Гц). Колебат. уровни энергии определяются квантованием колебат. движения атомных ядер. Двухатомные молекулы. В простейшем случае двухатомную молекулу представляют моделью двух взаимодействующих точечных масс m1 и m2 с равновесным расстоянием rе между ними (длина связи), а колебат. движение ядер считается гармоническим и описывается единств, координатой q=r-re, где r - текущее межъядерное расстояние. Зависимость потенциальной энергии колебат. движения V от q определяют в приближении гармонич. осциллятора [колеблющаяся материальная точка с приведенной массой m=m1m2/(m1+m2)] как ф-цию V=l/2(Keq2), где Ке=(d2V/dq2)q=0 - гармонич. силовая постоянная
|
|
|
Поглощение в УФ- и видимой областях.
Спектры поглощения в УФ- и видимой областях содержат как качественную, так и количественную информацию о поглощающем веществе. Последнее и позволяет использовать их в аналитической химии. Поглощение света подчиняется закону Ламберта – Бера
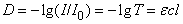
где D – оптическая плотность, I 0 и I – интенсивности падающего и прошедшего через образец света, T – пропускание, e – молярный коэффициент экстинкции, l – длина оптического пути (толщина поглощающего слоя) в см, c – молярная концентрация. Измерив оптическую плотность D, из соотношения D = ecl можно найти концентрацию поглощающего вещества.
Образцы, используемые в абсорбционной спектроскопии в УФ- и видимой областях, – это, как правило, разбавленные растворы. Диапазон концентраций, которые можно определить, зависит от молярного коэффициента экстинкции исследуемого вещества, максимальное значение которого составляет ~105 (отметим, что измерения следует проводить при длине волны, соответствующей максимуму в спектре поглощения). Для получения достоверных результатов измеряемая оптическая плотность должна находиться в диапазоне 0,01–2. При толщине поглощающего слоя в 1 см это соответствует концентрации 10–8 М, что в 1000 раз ниже, чем при титровании. Обычно в рабочей области (области линейности) измерений концентрация может изменяться по меньшей мере в 100 раз. Селективно подбирая длину волны, отвечающую максимуму поглощения вещества, можно исключить влияние матрицы (растворителя). Измерения оптической плотности непродолжительны, что позволяет определять с их помощью скорости реакций. Если исследуется смесь нескольких поглощающих веществ, то концентрацию каждого из них определяют, проводя измерения при длинах волн, отвечающих максимумам поглощения этих веществ.
Спектры поглощения в видимой и УФ-областях, возникают в результате электронных переходов в атомах и молекулах.
Поглощение же в ИК-области обусловлено переходами между колебательными уровнями, отвечающими разной колебательной энергии функциональных групп. В ИК-спектроскопии чаще всего используют среднюю часть ИК-области, 4000–200 см–1. Значения молярных коэффициентов экстинкции для ИК-области меньше, чем для видимой и УФ-областей, поэтому с помощью ИК-спектроскопии можно исследовать или чистые вещества, или очень концентрированные растворы. Жидкости заливают между оптически прозрачными стеклами, где они образуют тонкую пленку, или в кювету, твердые вещества измельчают и суспендируют в оптически прозрачной среде. Растворы исследовать сложнее, чем твердые вещества, поскольку растворитель часто поглощает в этой же области. Чтобы повысить чувствительность и разрешающую способность метода, в современных модификациях используют ИК-спектроскопию с фурье-преобразованием.
|
|
|


