 |
Дать общее математическое выражение и графическое изображение располагаемой работы: указать, когда она имеет положительный и отрицательный знак.
|
|
|
|
Уравнение состояния идеального газа для 1 кг и 1 кмоля.
Идеальный газ – это воображаемый газ, массы и объёмы молекул, которых равны нулю.

где p – давление [н/м2]
v – удельный объём [м3/кг]
R – газовая постоянная [287 дж/кг*град]
T – абсолютная температура [°К]

где G – масса [кг]
V – объём [м3]
Количество вещества по массе в килограммах, численно равное молекулярному весу µ данного вещества называется килограмм-молекулой или молем.

где Vµ - объём моля любого газа [22,4 м3/моль]
R0 – универсальная газовая постоянная [8314 дж/моль*град]
Основные виды теплоёмкости газов
Удельная теплоёмкость численно равна количеству теплоты которую необходимо сообщить рабочему телу, чтобы температура его какой-либо количественной единицы изменилась на 1°С
1) на 1 моль – мольная µс [кДж/моль*К]
2) на 1 кг – весовая (массовая) с [кДж/кг*К]
3) на 1 нм3 – объёмная с’ [кДж/нм3*К]

где рн – нормальное давление
Теплоёмкости бывают истинные (для одной температуры) и средние (для интервала температур). Теплоёмкость зависит от характера процесса и свойств газа. Теплоёмкость при р=const – изобарная (ср), а при V=const – изохорная (cv).
Уравнение первого закона термодинамики для закрытой системы.
Первый закон термодинамики для закрытой системы

где U1 и U2 – внутренняя энергия в начальном и конечном состоянии.

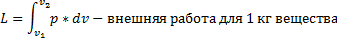
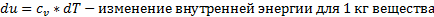
Составить общее математическое выражение работы расширения.
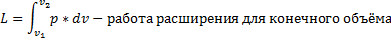

Площадь области m12n представляет собой графическое выражение работы обратимого процесса и равна ей по знаку и величине.
Что представляет собой внутренняя энергия и записать формулу для 1 кг вещества.
Внутренняя энергия U, обусловленная термическим состоянием системы, представляет собой сумму кинетической энергии поступательного и вращательного движения молекул, энергии колебания атомов в молекуле, а так же потенциальной энергии взаимодействии масс молекул (потенциальной энергии давления).
|
|
|
 [Дж]
[Дж]
где R - универсальная газовая постоянная [8314 Дж/моль*К]
M – молярная масса
k – коэффициент атомности газа [3/2, 5/2, 7/2]
Что выражает собой изменение внутренней энергии в изохорном и адиабатном процессах согласно 1-з. термодинамики?
1-з.: Изменение внутренней энергии U неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершённой системой над внешними телами.
ΔU = Q – A или Q = ΔU + A: Количество теплоты, полученной системой, идёт на изменение её внутренней энергии и совершение работы над внешними телами.
Изохорный: V = const, т. е. газ работы не совершает, а работа А = 0.
Q = ΔU = U (T2) – U (T1), где U (T2) – U (T1) разность начального и конечного состояния газа. Она зависит только от температуры (закон Джоуля). При изохорном нагревании тепло поглощается газом (Q > 0), и его внутренняя энергия увеличивается. При охлаждении тепло отдаётся внешним телам (Q > 0).
Адиабатный: Q = 0.
A = –ΔU. Газ совершает работу за счёт убыли его внутренней энергии.

При адиабатном расширении газ совершает положительную работу (A > 0), поэтому его внутренняя энергия уменьшается (ΔU < 0). Это приводит к понижению температуры газа. Вследствие этого давление газа при адиабатном расширении убывает быстрее, чем при изотермическом.
Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
Уравнение адиабатического процесса для идеального газа:
pVγ = const.
Что называется открытой термодинамической системой. Записать уравнение первого закона термодинамики для неё. Объяснить, что представляют собой отдельные члены уравнения для идеального газа при обратимых процессах.
|
|
|
Открытая ТД-система обменивается с внешней средой энергией и теплом.
Уравнение 1-з.: ΔU = ΔQ – ΔA + ΔEm

Уравнение идеального газа при обратимых процессах:
PV=RT, где P — давление, V — молярный объём, R — универсальная газовая постоянная, T — абсолютная температура, К.
8. Что называется располагаемой работой процесса и из чего она складывается?
Дать общее математическое выражение и графическое изображение располагаемой работы: указать, когда она имеет положительный и отрицательный знак.
Располагаемая работа - это работа, которая может быть совершена только в открытой системе, и её не следует смешивать с работой расширения газа (ΔL = рdV), совершаемой в закрытой системе. Количества этих работ по-разному выражаются через параметры состояния и представляются разными площадями в р-V-диаграмме.


|
|
|


