 |
Известковый метод (декарбонизация).
|
|
|
|
Общие сведения об умягчении воды.
Выбор методов водоподготовки в системах технического водоснабжения зависит от качества воды в источнике водоснабжения и требований к качеству очищаемой воды, которые определяются регламентом технологических процессов и разрабатываются отраслевыми НИИ. Для технического водоснабжения используются воды поверхностных источников. В редких случаях, по согласованию с соответствующими органами, разрешают использовать подземные воды. Как правило, вода, используемая в техническом водоснабжении по таким показателям как мутность, цветность, запахи, привкусы, бактериологическим показателям не регламентируются. Чаще всего требуется реализовывать специальные методы водоподготовки (умягчение, обессоливание, обескремнивание, дегазация).
Умягчение – процесс приводящий к удалению из воды катионов жесткости Са2+, Mg2+.
В подземной воде жесткость составляет 1,5-15 мг-экв/л. В соответствии с требованиями СанПиНа 10-124РБ99 общая жесткость воды для хозяйственно-питьевых целей Жобщ ≤ 7 мг-экв/л, для воды, используемой в технологических процессах в промышленности – 0,05-0,1 мг-экв/л.
Понятие карбонатной, некарбонатной и общей жесткости связаны с тем, какие анионы соединены в водном растворе с катионами Са2+, Mg2+.
 Са2+ НСО3- Са(НСО3)2; Mg(НСО3)2 → Жк
Са2+ НСО3- Са(НСО3)2; Mg(НСО3)2 → Жк
гидрокарбонаты Са2+, Mg2+.
и
 Mg2+ SO42-; Cl-
Mg2+ SO42-; Cl-
МgSO4; СаSO4; MgCl2; CaCl2 → Жнк
Жобщ = Жк + Жнк
Жк = Жобщ – Жнк = Щ

20, 12 – эквивалентные массы.
Т.е. Жк обусловлена присутствием в воде гидрокарбонатов Са2+и Mg2+.
Жнк обусловлена наличием в воде хлоридов и сульфатов.
Кроме того, жесткость карбонатная или щелочность обусловлена наличием в воде: ОН-; СО32-; НSiO3-; SiO32-; HPO42-.
|
|
|
Чтобы установить какая жесткость преобладает в воде строят диаграммы гипотетического состояния воды. Для этого в верхней части в масштабе откладывают концентрации содержащихся в воде катионов по мере возрастания их щелочности слева направо. А в нижней части – откладываются содержащиеся в воде анионы по мере возрастания кислотности слева направо, в мг/л.

Классификация методов
Различают следующие методы умягчения:
1) Термический метод применяется для устранения карбонатной жесткости воды, употребляемой для питания котлов;
2) Реагентный метод применяется для неглубокого умягчения при одновременном удалении из воды взвешенных веществ (известковый метод, известково-содовый, едко-натриевый, фосфатный, бариевый).
3) Ионообменный метод применяется для глубокого умягчения;
4)Диализ – фильтрование воды через полупроницаемую мембрану, применяется для глубокого умягчения.
Область применения различных методов умягчения.
| Наименование метода | Условия применения | Остаточная жесткость, мг-экв/л | Температура воды, °С | |
| Мутность исходной воды, мг/л | Жесткость исходной воды, мг-экв/л | |||
| Термический | до 50 | Жк с преобладанием Са(НСО3)2, Жнк в виде гипса (СaSO4) | Жк до 0,035 СаSO4 до 0,7 | До 270 |
| Реагентный | до 500 | Жобщ =5-35 | Жобщ до 0,7 | До 90 |
| Ионообменный | 5 - 8 | Жобщ до 15 | При одноступенчатой схеме: Жобщ=0,1-0,2; При двухступенчатой схеме: Жобщ=0,01-0,05 | До 30 |
| Диализ | до 2 | Жобщ до 10 | Жобщ до 0,01 | До 60 |
Умягчение воды реагентны методом основано на обработке ее реагентами, анионы которых образуют с катионами Са2+и Mg2+ нерастворимые соединения СаСО3↓, Mg(OH)2↓,Са(РО4)2, Мg(РО4)2 и др.
В зависимости от используемых реагентов методы реагентного умягчения классифицируются:
1)известковый;
2)известково-содовой;
3)едко-натриевый;
4)фосфатный; 5)бариевый.
Известковый метод (декарбонизация).
Применяется для частичного устранения из воды карбонатной жесткости. Иногда этот метод сочетают с содовым методом или ионообменным (катионитовых).
|
|
|
Химизм процесса:
Известь Са(ОН)2 в виде известкового молока
Са(ОН)2+СО2 = СаСО3↓+Н2О (1)
По реакции 1 идет связывание свободной углекислоты СО2 растворенной в воде.
Са(НСО3)2+Са(ОН)2=2СаСО3↓+2Н2О (2)
присутствует в воде в большом
кол-ве
Mg(НСО3)2+Са(ОН)2=МgСО3+Н2О+СаСО3↓ (3)
По 2 реакции образуется СаСО3.
MgСО3+Са(ОН)2=Мg(ОН)2+СаСО3↓ (4)
По реакциям 3 и 4 происходит связывание Са2+и Mg2+.
Доза вводимой извести (Ди) зависит от соотношения концентрации в воде ионов Са2+и жесткости карбонатной (согласно п.5 СНиП 2.04.02-84, приложение 7 стр108).
При соотношении:
а) 
 , мг/л
, мг/л
б) 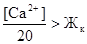
 , мг/л
, мг/л
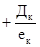 - если коагулянт вводят в воду после извести или одновременно с ней;
- если коагулянт вводят в воду после извести или одновременно с ней;
 - если коагулянт вводят в воду до извести;
- если коагулянт вводят в воду до извести;
[CO2] – содержание в воде свободной углекислоты,мгл;
[Ca2+] – концентрация ионовСа2+ в исходной воде, мг/л;
Дк – доза коагулянта, мг/л (в качестве коагулянта используется FeCl3 или FeSO4).
ек – эквивалентная масса, мг/мг-экв, для FeCl3 – 54 мг/мг-экв, для FeSO4 – 76 мг/мг-экв;
0,3;0,5 – избыток извести для полноты реакции.
 , мг/л
, мг/л
С – количество образующейся при реагентном умягчении воды взвеси, мг/л (с пересчете на сухое вещево).
Для случая а) 
б) 
m– содержание СаО в технической извести (в товарном продукте), %
Ди=25-35 мг/л (принимаем ориентировочно).
Известково-содовый метод.
Основан на введении в воду извести (Са(ОН)2) и соды (Na2CO3). Принимается для карбонатной и некарбонатной жесткости.
Механизм процесса:
1. По реакции (1-4) предыдущего метода при введении извести удаляется карбонатная жесткость и одновременно карбонатная магниевая жесткость переходит в карбонатную кальциевую жесткость.
2. По следующим уравнениям (5) и (6) удаляется кальциевая некарбонатная жесткость.
СаCl2 + Na2CO3 = CaCO3↓ + 2NaCl (5)
СаSO4 + Na2CO3 = CaCO3↓ + Na2SO4 (6)
Доза извести и соды определяется По СНиП 2.04.02-84, стр.108, п.6, приложение 7.
Остаточная жесткость после умягчения (т.е. после применения извести и соды) должна быть:
Жобщ = 0,5-1,0 мг-экв/л, а щелочность - Щ = 0,8-1,2 мг-экв/л.
Процесс умягчения этим методом проводят в две стадии:
1) Удаляют из воды органические примеси и большую часть карбонатной жесткости, применяя соли алюминия или железа и извести, тем самым создавая оптимальные условия для протекания процесса коагуляции;
|
|
|
2) Затем вводят в оду соду и остальную часть извести при рН >10,2 (эта среда необходима для удаления магниевой жесткости). Соли алюминия в качестве коагулянта не применяют, т.к. эта соль (Al2(SO4)3) образует растворимые алюминаты, не обеспечивая выделение из воды солей жесткости в виде осадка. Если органические примеси удаляют из воды совместно с умягчением, то в качестве коагулянтов применяют исключительно соли железа (FeSO4, FeCl2).Соль алюминия применяют, если устраняется жесткость только карбонатная при условии [Ca2+] > [HCO3-].
Доза коагулянта определяется по формуле:




|
|
|


