 |
Кинетика химических реакций
|
|
|
|
Экзаменационные тесты по химии
Для студентов 1 курса общемедицинского и стоматологического факультетов
На 2015-2016 уч.год
Экзаменационные тесты по неорганической, ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ химии 15-16
Учение о растворах
1. Для какого вещества фактор эквивалентности (fэ) равен единице?
1) Na2SO4
2) NaNO3
3) СaCl2
4) Na2CO3
5) Na3PO4
2. ФАКТОР ЭКВИВАЛЕНТНОСТИ (fэ) РАВЕН 1/2 ДЛЯ ВЕЩЕСТВ
1) Ca3(PO4)2
2) Na3PO4
3) ВаSO4
4) KNO3
5) CaCl2
6) NaBr
7) KCl
3. Для какого вещества фактор эквивалентности (fэ) равен 1/3?
1) Na2CO3
2) Na3PO4
3) NaNO3
4) Ca(OH)2
5) Al2(SO4)3
4. ФАКТОР ЭКВИВАЛЕНТНОСТИ (fэ) РАВЕН 1/6 ДЛЯ ВЕЩЕСТВ
1) Mg(NO3)2
2) Ca3(PO4)2
3) Al2(SO4)3
4) Al(OH)3
5) Na3PO4
6) NaNO3
7) CaCl2
8) KCl
5. Какая концентрация измеряется в моль/кг?
1) молярная концентрация
2) молярная концентрация эквивалента
3) моляльная концентрация
4) массовая доля
5) мольная доля
6. По какому соотношению рассчитывается молярная концентрация?
1) 
2) 
3) 
4) 
5) 
7. По какому соотношению рассчитывается молярная концентрация эквивалента?
1) 
2) 
3) 
4) 
5) 
8. По какой формуле рассчитывается массовая доля раствора?
1) 
2) 
3) 
4) 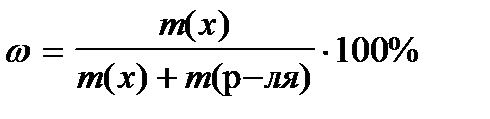
5) 
9. В 1 литре содержится 3,65 г хлороводорода. Чему равна молярная концентрация этого раствора?
1) 1 моль/л
2) 0,5 моль/л
3) 0,1 моль/л
4) 0,05 моль/л
5) 0,01 моль/л
10. В хирургии применяются гипертонические марлевые повязки, пропитанные 10%-ным водным раствором хлорида натрия. Сколько г соли и воды нужно взять для приготовления 500 г такого раствора?
1) 5 и 495
2) 10 и 490
3) 25 и 475
4) 50 и 450
5) 75 и 425
11. В 95 г воды растворили 5 г глюкозы. Чему равна массовая доля глюкозы (%) в полученном растворе?
1) 5,00
2) 5,26
3) 5,56
4) 5,88
5) 6,00
12. Повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя
|
|
|
1) равно нулю
2) прямо пропорционально массовой доле растворенного вещества
3) прямо пропорционально мольной доле растворенного вещества
4) прямо пропорционально моляльности раствора
5) не зависит от концентрации растворенного вещества
13. Что означает запись «3%-ный раствор Н2О2»?
1) в 1 литре раствора содержится 3 г пероксида водорода
2) в 1000 г раствора содержится 3 г пероксида водорода
3) в 100 г раствора содержится 3 г пероксида водорода
4) в 100 г раствора содержится 3 моль пероксида водорода
5) в 1000 г растворителя содержится 3 г пероксида водорода
14. Эбуллиоскопическая константа воды 0,52о. Чему равна температура кипения водного раствора глюкозы, моляльная концентрация которого равна 1 моль/кг?
1) 100оС
2) 100,52оС
3) 101,04оС
4) 99,48оС
5) 98,96оС
15. ГИПЕРТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ
1) 15%-ный раствор NaCl
2) 10%-ный раствор NaCl
3) 0,9%-ный раствор NaCl
4) 0,1%-ный раствор NaCl
5) 5%-ный раствор NaCl
6) 0,15 М раствор NaCl
7) 0,01 М раствор NaCl
8) 0,3 M раствор NaCl
16. ИЗОТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ
1) 0,01%-ный раствор NaCl
2) 0,9%-ный раствор NaCl
3) 10%-ныйраствор NaCl
4) 15%-ный раствор NaCl
5) 5%-ный раствор NaCl
6) 0,15 М раствор NaCl
7) 0,01M раствор NaCl
8) 0,3 M раствор NaCl
9) 1 М раствор NaCl
17. ГИПОТОНИЧНЫ ПО ОТНОШЕНИЮ К ПЛАЗМЕ КРОВИ РАСТВОРЫ
1) 0,01%-ный раствор NaCl
2) 0,9%-ный раствор NaCl
3) 10%-ныйраствор NaCl
4) 15%-ный раствор NaCl
5) 5%-ный раствор NaCl
6) 0,05 М раствор NaCl
7) 0,01M раствор NaCl
8) 0,3 M раствор NaCl
9) 1 М раствор NaCl
18. Водный раствор какого из перечисленных ниже веществ имеет самую высокую температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы?
1) С6Н12О6
2) NaNO3
3) Ca(NO3)2
4) Al(NO3)3
5) Al2(SO4)3
19. Водный раствор какого из перечисленных ниже веществ имеет самую низкую температуру замерзания, при условии, что молярные концентрации эквивалента этих растворов одинаковы?
1) С6Н12О6
2) КNO3
3) Mg(NO3)2
4) Fe(NO3)3
5) Al2(SO4)3
|
|
|
20. При одинаковой температуре растворы с молярной концентрацией 0,1 моль/л изотоничны друг другу. Для какой пары растворов будет соблюдаться это условие?
1) фруктоза и хлорид натрия
2) хлорид натрия и сульфат натрия
3) сахароза и хлорид магния
4) нитрат кальция и сульфат натрия
5) хлорид калия и сульфат калия
21. Как называется часть осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов?
1) давление насыщенного пара над чистым растворителем
2) давление насыщенного пара растворителя над раствором
3) систолическое давление
4) диастолическое давление
5) онкотическое давление
22. Как называется раствор с осмотическим давлением большим, чем в стандарте?
1) гипотонический
2) изотонический
3) физиологический
4) насыщенный
5) гипертонический
23. Какое явление наблюдается при помещении эритроцитов в 10%-ный раствор хлорида натрия?
1) гемолиз
2) плазмолиз
3) деплазмолиз
4) ультрафильтрация
5) эндосмос
24. Какое явление наблюдается при помещении эритроцитов в 0,1%-ный раствор хлорида натрия?
1) гемолиз
2) плазмолиз
3) диализ
4) коагуляция
5) экзосмос
25. Растворы перечисленных ниже солей имеют одинаковую молярную концентрацию 0,01 моль/л. Какая пара растворов содержит одинаковое число частиц в 1 литре раствора?
1) Na2SO4и NaCl
2) Na2CO3и NaBr
3) NaBr и K2SO4
4) NaCl и KBr
5) NaCl и Na3PO4
26. Количество вещества эквивалента можно рассчитать как отношение
1) молярной массы вещества к его массе
2) массы вещества к его молярной массе
3) молярной массы эквивалента вещества к его массе
4) массы вещества к его молярной массе эквивалента
5) массы вещества к массе раствора
27. Какую величину можно рассчитать как произведение фактора эквивалентности и молярной массы вещества?
1) массовую долю
2) молярную концентрацию
3) молярную концентрацию эквивалента
4) молярную массу эквивалента
5) мольную долю
28. Какая величина представляет собой отношение количества растворенного вещества к объему раствора?
1) молярная концентрация
2) молярная концентрация эквивалента
3) массовая доля
4) мольная доля
5) моляльная концентрация
29. Какая величина представляет собой отношение количества растворенного вещества к массе растворителя?
1) молярная концентрация
|
|
|
2) молярная концентрация эквивалента
3) массовая доля
4) мольная доля
5) моляльная концентрация
Буферные растворы
1. Какое утверждение верно для нейтрального раствора?
1) [H+] = [OH-]
2) [H+] = 14 - [OH-]
3) [H+] < [OH-]
4) [H+] × [OH-] = 14
5) [H+] > [OH-]
2. Какой компонент гидрокарбонатного буферного раствора будет реагировать при добавлении к нему небольшого количества хлороводородной кислоты?
1) H2CO3
2) NaHCO3
3) Na2CO3
4) CaCO3
5) K2CO3
3. По какому уравнению можно рассчитать концентрацию ионов водорода в ацетатном буферном растворе?
1) 
2) 
3) 
4) 
5) 
4. Какие соединения входят в состав гидрокарбонатного буферного раствора?
1) H2CO3 и NaHCO3
2) Na2CO3и K2CO3
3) Na3PO4 и Na2HPO4
4) CaCO3 и H2CO3
5) K2CO3 и CaCO3
5. Какие соединения входят в состав фосфатного буферного раствора?
1) Na3PO4и H3PO4
2) Na2HPO4и NaH2PO4
3) NaH2PO4
4) Na3PO4и Na2НPO4
5) Ca3(PO4)2
6. Какие соединения входят в состав аммиачного буферного раствора?
1) NH4NO3и (NH4)2SO4
2) (NH4)2CO3 и NH4Cl
3) NH4Cl и NH4OH
4) (NH4)2SO4
5) NH4OH и HCl
7. СООТНОШЕНИЕ [H+] < [OH-] СОБЛЮДАЕТСЯ В ВОДНЫХ РАСТВОРАХ
1) CH3COOH
2) Са(OH)2
3) NH4OH
4) H3PO4
5) NaOH
6) NaCl
7) KCl
8. СООТНОШЕНИЕ [H+] > [OH-] СОБЛЮДАЕТСЯ В ВОДНЫХ РАСТВОРАХ
1) Са(OH)2
2) NH4OH
3) H3PO4
4) HNO3
5) NaOH
6) NaCl
7) KOH
8) HCl
9. Чему равна концентрация ионов [H+] в чистой воде при 25°С (моль/л)?
1) 10-14
2) 10-7
3) 107
4) 101
5) 7
10. Чему равна концентрация Сон-, если Сн+ = 10-4?
1) 14
2) 10-14
3) 10-7
4) 10-10
5) 10-4
11. Чему равна сумма рН и рОН для разбавленных водных растворов?
1) 10-14
2) 10-7
3) 1
4) 7
5) 14
12. Как называется смещение реакции среды в организме в кислую сторону?
1) осмос
2) ацидоз
3) алколоз
4) гидролиз
5) нейтрализация
13. Как называется смещение реакции среды в организме в щелочную сторону?
1) ацидоз
2) алколоз
3) гидролиз
4) гомеостаз
5) нейтрализация
14. Чему равна концентрация ионов водорода (моль/л) в водном растворе с рОН =11?
1) 10-1
2) 10-3
3) 10-5
4) 10-9
5) 10-11
15. Какова реакция среды, если рОН = 13?
1) кислая
2) щелочная
3) слабощелочная
4) слабокислая
5) нейтральная
16. Чему равен рН раствора гидроксида натрия с СNаОН = 0,001 моль/л?
1) 10-2
2) 2
3) 9
4) 11
5) 10-12
17. ДЛЯ РАСТВОРА HCl С КОНЦЕНТРАЦИЕЙ 0,1 МОЛЬ/Л СПРАВЕДЛИВЫ СООТНОШЕНИЯ
|
|
|
1) [H+] = [OH-]
2) [H+] > [OH-]
3) [H+] < [OH-]
4) [OH-] = 10-13
5) [OH-] = 10-1
6) [H+] = 10-13
7) [H+] = 10-1
8) pOH = 1
9) pH = 1
18. УСЛОВИЕ [H+] > [OH-] ВЫПОЛНЯЕТСЯ ДЛЯ ВОДНЫХ РАСТВОРОВ ВЕЩЕСТВ
1) CH3COOH
2) NH4OH
3) NaOH
4) H2SO4
5) KOH
6) NaCl
7) HCl
19. По какой формуле можно рассчитать концентрацию ионов водорода в растворе уксусной кислоты?
1) [H+] = Cк-ты
2) [H+] = a×Кк-ты
3) [H+] = 
4) [H+] = 14 - [OH-]
5) [H+] = 10-14
20. По какой формуле можно рассчитать концентрацию ионов водорода в растворе гидроксида аммония?
1) [H+] = Cосн
2) [H+] = a×Cосн
3) [H+] = 10-14 - [OH-]
4) [H+] = 14 - [OH-]
5) [H+] = 
21. ДЛЯ РАСТВОРА КОН С КОНЦЕНТРАЦИЕЙ 0,01 МОЛЬ/Л ВЕРНО
1) [H+] = [OH-]
2) [H+] > [OH-]
3) [H+] < [OH-]
4) [OH-] = 10-12
5) [OH-] = 10-2
6) [H+] = 10-12
7) [H+] = 10-2
22. Чему равна константа ионизации Kb для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и степенью ионизации a=0,001?
1) 10-1
2) 10-3
3) 10-4
4) 10-5
5) 10-7
23. Чему равна степень ионизации a для раствора слабого однокислотного основания с концентрацией 0,1 моль/л и константой ионизации Kb равной 10-7?
1) 0,1
2) 0,01
3) 0,001
4) 10-4
5) 10-5
24. Как называется объемная доля химически связанного СО2 в 100 мл плазмы крови?
1) щелочным резервом крови,
2) водородным показателем крови,
3) осмотическим давлением крови,
4) буферной емкостью крови,
5) концентрацией крови.
Комплексные соединения
1. Чему равна степень окисления комплексообразователя в ионе [Co(CN)4(H2O)2]-?
1) +4
2) +5
3) +3
4) +6
5) +2
2. Чему равна степень окисления комплексообразователя в частице [CrCl2CN(H2O)3]?
1) +3
2) +6
3) +4
4) +5
5) +2
3. Чему равен заряд комплексной частицы [Co(NO2)3(NH3)3] x, в которой комплексообразователем является Со (III)?
1) 3+
2) 3 –
3) 0
4) 2 –
5) 1+
4. Чему равен заряд комплексного иона [PtCl(OH)5] x, в котором комплексообразователем является Pt(IV)?
1) 2+
2) 2 –
3) 4+
4) 3 –
5) 3+
5. Какая формула соответствует комплексному соединению монобромопентанитроплатинат (IV) калия?
1) K[PtBr(NO2)5]
2) [PtBr(NO2)5]K
3) K2[Pt(NO2)5Br]
4) [Pt(NO2)5]KBr
5) [KBr][Pt(NO2)5]
6. Какая формула соответствует комплексному соединению пентацианомоноамминферрат (II) натрия?
1) Na[Fe(CN)5NH3]
2) Na2[Fe(CN)6NH3]
3) Na(NH3)[Fe(CN)6]
4) [Fe(CN)6NH3]Na
5) Na3[Fe(CN)5NH3]
7. Какая формула соответствует комплексному соединению сульфат пентаамминбромокобальта (III)?
1) [CoBr(NH3)5]SO4
2) [CoBr][(NH3)5·SO4]
3) [Co(NH3)5]BrSO4
4) (NH3)5[CoBrSO4)
5) Co[Br(NH3)5SO4]
8. Чему равна степень окисления золота в комплексном ионе [Au(CN)2Br2]-?
1) +3
2) +4
3) +5
4) +6
5) +2
9. КАТИОННЫМ КОМПЛЕКСАМ СООТВЕТСТВУЮТ ФОРМУЛЫ
1) [Cr(CNS)2H2O(NH3)3]Br
2) [Co(NH3)3(NO2)3]
3) [CoBr(NH3)5]SO4
4) Ca[Al(OH)5H2O]
5) Ca[Al(OH)5H2O]
6) [CrCl(NH3)5]Cl2
7) [PtCl3(NH3)3]
8) K2[PtCl6]
10. АНИОННЫМ КОМПЛЕКСАМ СООТВЕТСТВУЮТ ФОРМУЛЫ
1) [CrOH(H2O)2(NH3)3]Br2
2) [Cr(CNS)2H2O(NH3)3]Br
3) [CoBr(NH3)5]SO4
4) [CrCl(NH3)5]Cl2
5) Ca[Al(OH)5H2O]
6) Ba2[Fe(CN)6]
7) [PtCl4(NH3)2]
8) [PtCl3(NH3)3]
11. НЕЙТРАЛЬНЫМ КОМПЛЕКСАМ СООТВЕТСТВУЮТ ФОРМУЛЫ
|
|
|
1) [Cr(CNS)2H2O(NH3)3]Br
2) [Co(NO2)2(NH3)3]Cl
3) Ca[Al(OH)5H2O]
4) [PtCl3(NH3)3]Br
5) [PtCl(NH3)3]Cl
6) [PtCl4(NH3)2]
7) [PtCl3(NH3)3]
8) K2[PtCl6]
12. Что является комплесообразователем в комплексном соединении [Co(NH3)5Cl]Cl2?
1) Co2+
2) [Co(NH3)5Cl]2+
3) Co3+
4) 5 NH3 и Cl-
5) 2Cl-
13. ЛИГАНДАМИ В КОМПЛЕКСНОМ СОЕДИНЕНИИ (NH4)2[Pt(OH)2Cl4] ЯВЛЯЮТСЯ
1) [Pt(OH)2Cl4]2-
2) 2NH4+
3) 2OH-
4) 4Cl-
5) Pt4+
6) Pt2+
14. Что является комплесообразователем в комплексном соединении (NH4)2[Pt(OH)2Cl4]?
1) 2OH-
2) Pt2+
3) Pt4+
4) 4Cl-
5) 2NH4+
15. Как называется химическая связь, при образовании которой электроны практически полностью переходят от одного взаимодействующего атома к другому?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
16. Как называется химическая связь, при образовании которой электроны лишь частично смещаются от одного взаимодействующего атома к другому?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
17. Как называется химическая связь, при образовании которой электроны в равной степени принадлежат обоим атомам?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
18. Как называется химическая связь, характерная для соединений, содержащих сильно полярные ковалентные связи между атомом водорода и элементом с высокой электроотрицательностью?
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
5) металлическая
19. Как называется максимальное число координационных мест, которые способен занимать лиганд?
1) буферная ёмкость
2) дентантность
3) ёмкость поглощения
4) теплоёмкость
5) электроёмкость
Строение атома. Биогенные элементы
1. Сколько всего электронов имеет частица Ва2+, если порядковый номер бария равен 56?
1) 58
2) 57
3) 56
4) 55
5) 54
2. Сколько всего электронов имеет частица I-, если порядковый номер иода равен 53?
1) 55
2) 54
3) 53
4) 52
5) 51
3. Сколько всего электронов имеет частица Fe3+, если порядковый номер железа равен 26?
1) 29
2) 27
3) 26
4) 25
5) 23
4. ТОКСИЧНЫ ДЛЯ ЧЕЛОВЕКА СОЕДИНЕНИЯ
1) водорода
2) кадмия
3) кальция
4) натрия
5) магния
6) свинца
7) калия
8) ртути
5. Какой элемент является основой соединений костной ткани?
1) натрий
2) свинец
3) кальций
4) калий
5) мышьяк
6. В КАЧЕСТВЕ АНТИСЕПТИЧЕСКИХ СРЕДСТВ В МЕДИЦИНЕ ПРИМЕНЯЮТСЯ РАСТВОРЫ ВЕЩЕСТВ
1) NH4OH
2) KMnO4
3) CaCl2
4) ZnCl2
5) Н2О2
6) NaCl
7) NO2
8) HCl
7. Раствор какого вещества применяют в медицине для повышения кислотности желудочного сока?
1) НNO3
2) HCl
3) KMnO4
4) NaHCO3
5) NH4OH
8. Какое вещество применяют в медицине при повышенной кислотности желудочного сока и изжоге?
1) Nа2CO3
2) HCl
3) NaОH
4) NaHCO3
5) NH4OH
9. Какой ион является основным внутриклеточным ионом?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
10. Какой ион является основным внеклеточным ионом?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
11. К МАКРОЭЛЕМЕНТАМ ОТНОСЯТСЯ
1) Mn
2) Rb
3) Cs
4) Сu
5) Ca
6) Cl
7) К
8) I
12. ОРГАНОГЕНАМИ ЯВЛЯЮТСЯ
1) Mn
2) Na
3) Ca
4) Fe
5) Cu
6) N
7) P
8) C
13. К МИКРОЭЛЕМЕНТАМ ОТНОСЯТСЯ
1) Mg
2) Ca
3) Cu
4) Cl
5) O
6) S
7) C
8) I
14. При недостатке в организме какого элемента возникает заболевание «эндемический зоб»?
1) C
2) I
3) Ca
4) O
5) Mn
15. Какой ион является комплексообразователем в гемоглобине?
1) К+
2) Na+
3) Ca2+
4) Fe2+
5) Mn7+
16. При недостатке в организме какого элемента развивается остеопороз?
1) К
2) Na
3) Ca
4) Fe
5) Mn
17. При избытке фтора возникает
1) кариес
2) флюороз
3) антракоз
4) рахит
5) силикоз
18. В результате систематического вдыхания каменноугольной пыли развивается
1) силикоз
2) антракоз
3) алюминоз
4) флюороз
5) кариес
19. При систематическом вдыхании пыли алюминия и его оксида развивается болезнь:
1) антракоз
2) силикоз
3) флюороз
4) алюминоз
5) кариес
Химическая термодинамика
1. Какой термодинамической системой является система «0,9%-ный раствор NaCl в запаянной ампуле»?
1) грубодисперсной
2) гетерогенной
3) изолированной
4) закрытой
5) открытой
2. ГОМОГЕННЫМИ ЯВЛЯЮТСЯ ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
1) насыщенный раствор хлорида натрия над осадком
2) разбавленный раствор сахара в воде
3) порошок лекарственного препарата
4) 0,9%-ный раствор хлорида натрия
5) кристаллический йод
6) растение
7) человек
3. ГЕТЕРОГЕННЫМИ ЯВЛЯЮТСЯ ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
1) разбавленный раствор глюкозы в воде
2) разбавленный раствор сахара в воде
3) порошок лекарственного препарата
4) разбавленный раствор NаС1 в воде
5) негазированная минеральная вода
6) животное
7) растение
4. Какая термодинамическая система обменивается с окружающей средой массой (веществом) и энергией?
8) открытая
9) закрытая
10) изолированная
11) гомогенная
12) гетерогенная
5. ЗАКРЫТЫМИ ЯВЛЯЮТСЯ ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
1) остывающий камень
2) идеальный термос
3) запаянная ампула
4) живая клетка
5) вселенная
6) растение
7) человек
6.Какая термодинамическая система (при равном количестве вещества) будет иметь наименьшее значение энтропии?
1) разбавленный раствор глюкозы
2) насыщенный раствор хлорида натрия над осадком
3) воздух
4) жидкий азот
5) кристаллический йод
7. Какая термодинамическая величина является мерой реакционной способности химической системы?
1) внутренняя энергия
2) температура системы
3) теплота образования продуктов реакции
4) энергия Гиббса
5) температура окружающей среды
8. Как изменяются теплота и энтальпия при протекании эндотермической реакции?
1) Q<0, DН>0
2) Q<0, DН<0
3) Q>0, DH>0
4) Q=0, DH<0
5) Q>0, DН=0
9. Как изменяются теплота и энтальпия при протекании экзотермической реакции?
1) Q<0, DН<0
2) Q>0, DH<0
3) Q>0, DH>0
4) Q<0, DН>0
5) Q=0, DH>0
10. При протекании какой химической реакции, идущей в газовой фазе, энтропия термодинамической системы не изменяется?
1) HCl + NH3®NH4Cl
2) C2H5OH + 3O2® 2CO2 + 3H2O
3) NI3NH3® N2 + ЗНI
4) H2 + Сl2® 2НСl
5) 2CO + O2® 2CO2
11. При протекании какой химической реакции, идущей в газовой фазе, энтропия термодинамической системы увеличивается?
1) 2N2O + 4O2® 2N2O5
2) 3Н2 + N2® 2NН3
3) 4НСl + O2 ® 2Сl2 + 2Н2O
4) N2 + О2® 2NO
5) 2Н2O2® 2H2O + O2
12. Какой термодинамической системой является человек?
1) открытой гомогенной
2) закрытой гетерогенной
3) изолированной гомогенной
4) открытой гетерогенной
5) закрытой гомогенной
13. Какие биохимические процессы протекают в клетках живого организма?
1) изобарные
2) изохорные
3) изотермические
4) изохорно-изотермические
5) изобарно-изотермические
14. ТЕПЛОТЫ ОБРАЗОВАНИЯ РАВНЫ НУЛЮ ДЛЯ ВЕЩЕСТВ
1) HNO3
2) CaCl2
3) N2O
4) NO2
5) NH3
6) Cl2
7) N2
8) О3
15. Как называется величина, равная количеству теплоты, выделяемому или поглощаемому при образовании 1 моль сложного вещества из простых веществ в стандартных условиях?
1) энтальпией сгорания
2) энтальпией нейтрализации
3) стандартной теплотой образования
4) стандартной теплотой разложения
5) стандартной энтальпией гидратации
16.«Теплота разложения какого-либо химического соединения равна по абсолютной величине и противоположна по знаку теплоте его образования» - это формулировка
1) первого начала термодинамики
2) второго начала термодинамики
3) закона Лавуазье-Лапласа
4) закона Гесса
5) следствия из закона Гесса
17. Какая формула соответствуют математическому выражению закона Лавуазье-Лапласа?
1) ΔG = ΔH – TΔS
2) Q = DU + A
3) DHd = -DHf
4) ΔS ≥ Q/T
5) Qp = DH
18. Чему будет равна энтальпия реакции разложения двух моль воды, если энтальпия реакции образования одного моль воды равна -241,6 кДж?
1) -241,6 кДж
2) +241,6 кДж
3) - 120,8 кДж
4) -483,2 кДж
5) +483,2 кДж
19. «Тепловой эффект химических реакций не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным видом и состоянием системы» - это формулировка
1) первого начала термодинамики
2) второго начала термодинамики
3) закона Лавуазье-Лапласа
4) закона Гесса
5) следствия из закона Гесса
20. ТЕПЛОТЫ ОБРАЗОВАНИЯ ОТЛИЧНЫ ОТ НУЛЯ ДЛЯ ВЕЩЕСТВ
1) CO2
2) NO
3) СО
4) Cl2
5) Br2
6) N2
7) O3
8) В
21. Как изменяется энтропия при изменении агрегатного состояния в ряду кристалл – жидкость – газ?
1) возрастает;
2) уменьшается;
3) не изменяется;
4) сначала возрастает, а потом уменьшается;
5) сначала уменьшается, а потом возрастает.
Кинетика химических реакций
1. Что такое скорость химической реакции?
1) изменение концентрации реагирующих веществ в единицу времени
2) число молекул, принимающих участие в элементарном акте химической реакции
3) число молекул субстрата, превращающихся под действием одной молекулы фермента
4) сумма показателей степеней в кинетическом уравнении реакции
5) изменение концентрации катализатора в единицу времени
2. Какое уравнение выражает зависимость скорости прямой реакции 2NO + O2 = 2NO2 от концентрации реагентов?
1) w = [NO]2 + [O2]
2) w = 2[NO][O2]
3) w = 2[NO2]2
4) w = k[NO][O2]
5) w = k[NO]2[O2]
3. Какое уравнение выражает зависимость скорости обратной реакции 2NO + O2 = 2NO2 от концентрации реагентов?
1) w = [NO2]2
2) w = 2[NO2]
3) w =k[NO2]2
4) w = k[NO][O2]
5) w = k[NO]2[O2]
4. Какое уравнение соответствует закону действующих масс для прямой реакции A + B + B®AB2?
1) w = k[B][B]
2) w = k[A][B]
3) w = k[A][B]2
4) w = k[AB2]
5) w = k[A][B2]
5. ОСОБЕННОСТЯМИ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ФЕРМЕНТОВ ЯВЛЯЮТСЯ
1) каталитическая активность, сопоставимая с неорганическими катализаторами
2) независимость каталитического действия от температуры
3) исключительно высокая каталитическая активность
4) независимость каталитического действия от рН
5) сверхчувствительность к изменению рН
6) отсутствие температурного оптимума
7) высокая специфичность действия
6. Каким уравнением выражается скорость реакции первого порядка?
1) w=k
2) w=k.ca. cb. cс
3) w=k. c
4) w=k. c2
5) w=k. ca.cb
7. В чем заключается функция ферментов в живом организме?
1) транспорт оксигенов
2) катализ биохимических реакций
3) обеспечение иммунитета
4) обеспечение энергией
5) перенесение кислорода к тканям и органам
8. СКОРОСТЬ РЕАКЦИИ ВЫРАЖАЕТСЯ КАК w = kC(O2) ДЛЯ РЕАКЦИЙ
1) 4Cu(т) + O2(г) ® 2Cu2O(т)
2) 2SO2(г) + O2(г) ® 2SO3(г)
3) O2(г) + 2H2(г) ® 2H2O(ж)
4) 2NO(г) + O2(г)® 2NO2(г)
5) CO(г) + O2(г) ® 2CO2(г)
6) 2C(т) + O2(г) ® 2CO(г)
7) N2(г) + O2(г) ® 2NO(г)
9. Как изменится скорость прямой химической реакции СаСО3(т) = СаО(т) + CO2(г), если давление в системе увеличить в 5 раз?
1) увеличится в 5 раз
2) уменьшится в 25 раз
3) уменьшится в 5 раз
4) увеличится в 25 раз
5) не изменится
10. Какая реакция является тримолекулярной?
1) H2 + J2 = 2HJ
2) J2 = 2J
3) 2NO + O2 = 2NO2
4) CO + Cl2 = COCl2
5) Ca(HCO3)2«H2O + CO2 + CaO
11. Какая формула соответствует константе равновесия реакции 2NO(г) + Cl2(г) ® 2NOCl(г)?
1) K = C2(NOCl) / C2(NO) . C(Cl2)
2) K = C2(NO) . C(Cl2)
3) K = C2(NO) . C(Cl2) / C2(NOCl)
4) K = C2(NOCl) / C2(NO) + C(Cl2)
5) K = C2(NO) + C(Cl2) / C2(NOCl)
12. Какая формула соответствует выражению закона действующих масс для прямой реакции CaCO3(т) ®CO2(г)+ CaO(т)?
1) w = k C(CaCO3)
2) w = k C(CaO) . C(CO2)
3) w = k
4) w = k (C(CaO) + C(CO2))
5) w = kC(CO2)
13. Температурный коэффициент реакции γ=2. Как изменится скорость химической реакции при увеличении температуры с 35оС до 65оС?
1) увеличится в 8 раз
2) уменьшится в 8 раз
3) не изменится
4) увеличится в 6 раз
5) уменьшится в 6 раз
14. Чему равна константа скорости химической реакции?
1) произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам
2) числу молекул, участвующих в элементарном акте химической реакции
3) сумме показателей степеней при концентрациях
4) скорости химической реакции при концентрациях реагирующих веществ, равных единице
5) скорости химической реакции в любой момент времени
15. Как количественно выражается влияние концентрации реагирующих веществ на скорость химической реакции?
1) правилом Вант-Гоффа
2) законом действующих масс
3) уравнением Аррениуса
4) уравнением Михаэлиса-Ментен
5) уравнением Гендерсона-Гассельбаха
16. Как количественно может быть описана зависимость константы скорости химической реакции от температуры?
1) правилом Панета-Фаянса
2) законом действующих масс
3) уравнением Аррениуса
4) уравнением Михаэлиса-Ментен
5) уравнением Гендерсона-Гассельбаха
17. ФЕРМЕНТАТИВНУЮ РЕАКЦИЮ ХАРАКТЕРИЗУЮТ УТВЕРЖДЕНИЯ
1) ферменты проявляют каталитическую активность в узком интервале температур
2) каталитическая активность ферментов зависит от кислотности или рН среды
3) энергия активации реакции при участии фермента не изменяется
4) фермент не образует промежуточное соединение с субстратом
5) ферменты обладают высокой специфичностью
6) один фермент ускоряет все биохимические реакции
7) ферменты повышают энергию активации
18. ГОМОГЕННЫМИ РЕАКЦИЯМИ ЯВЛЯЮТСЯ
1) FeO(т) + H2(г) ®Fe(т) + H2O(ж)
2) C(т) + H2O(ж) ®H2(г) + CO(г)
3) 2NO(г) + Cl2(г) ® 2NOCl(г)
4) 2H2(г) + O2(г)® 2H2O(г)
5) SO2(г) + O2(г)® 2SO3(г)
6) C(т) + 2H2(г) ®CH4(г)
7) C(т) + O2(г) ®CO2(г)
19. ГЕТЕРОГЕННЫМИ РЕАКЦИЯМИ ЯВЛЯЮТСЯ
1) FeO(т) + H2(г) ®Fe(т) + H2O(ж)
2) CO(г) + H2O(г) ®CO2(г) + H2(г)
3) NO(г) + O2(г) ®NO2(г)
4) 2SO2(г) + O2(г) ® 2SO3(г)
5) C(т) + CO2(г) ® 2CO(г)
6) C(т) + 2H2(г) ®CH4(г)
7) C(т) + O2(г) ®CO2(г)
|
|
|


