 |
Контроль за фенотипом нейронов в ПНС
|
|
|
|
Сходны ли механизмы, определяющие судьбу клеток в ПНС позвоночных с механизмами, определяющими развитие ЦНС? Например, какую роль играют происхождение клеток, время их образования и локальные сигналы в определении пути развития периферических нейронов и глиальных клеток? Запрограммированы ли клетки-предшественницы на формирование клеток определенного типа, например клеток автономной, а не сенсорной системы, или на использование этими клетками ацетилхолина, а не норадреналина, в качестве трансмиттера?
Подобные вопросы изучались в нервной системе цыплят и перепелок Ле Дуарином, Вестоном и другими. В эмбрионе позвоночных клетки нервного гребня, расположенные в разных местах вдоль нервной оси, образуют различные типы клеток ПНС (рис. 5А). Для изучения того, определен ли фенотип клеток, развивающихся из нервно го гребня, уже на ранних стадиях развития или он может изменяться при перемещении клеток в другое место вдоль нервной оси, Ле Дуарин пересаживал клетки из одного региона нервного гребня в другой регион эмбрионахозяина и затем исследовал развитие пересаженных клеток. В этих экспериментах клетки доноры брались из эмбриона перепелки и затем имплантировались в эмбрион-хозяин цыпленка таким образом, чтобы пересаженные клетки можно было различить по очевидным цитологическим отличиям между клетками перепелки и цыпленка (рис. 5В). После пересадки клетки куропатки развивались согласно своему новому расположению. Например, клетки, взятые из области, которая при нормальном развитии образовывала надпочечник, вместо этого образовывали иннервацию кишечника.
| Рис. 5. Судьба клеток нервного гребня определяется окружением. (А) Клетки нервного гребня образуют большое количество различных периферических ганглиев. Ресничный ганглий образован клетками из мезенцефального нервного гребня. Ганглий Ремака и кишечные ганглии тонкой кишки образуются из клеток вагальной (сомиты 1-7) и люмбосакральной (каудальнее S28) областей нервного гребня. Ганглии симпатической цепочки происходят из всех областей нервного гребня каудальнее S5. Надпочечник заселяется клетками нервного гребня из S18-S24. (В) Если клетки нервного гребня из S18-S24, которые должны образовать надпочечник, пересадить от донора-перепелки в вагальную или люмбосакральную область эмбриона цыпленка, они будут следовать пути развития, характерному для своего нового положения и заселят ганглий Ремака или кишечный ганглий тонкой кишки. | 
|
|
|
|
Близким вопросом является то, определен ли фенотип клеток нервного гребня до того, как клетки мигрируют прочь от нервной трубки или после того, как они достигнут своего окончательного месторасположения на периферии. Ответ на этот вопрос получен в исследованиях клеток нервного гребня, выделенных из одного периферического месторасположения: предшественника (primordiurn) надпочечника эмбриона млекопитающих. В культуре эти клетки образуют либо хромаффинные клетки, либо клетки мозгового вещества надпочечников, либо адренергические симпатические нейроны. Глюкокортикоиды (синтезируемые клетками коры надпочечника) вызывают экспрессию ферментов, специфических для хромаффинных клеток (рис. 6). И наоборот, два белка, присутствующие в местах образования симпатических ганглиев, называемые основной фактор роста фибробластов (basic fibroblast growth factor, bFGF) и фактор роста нерва (nerve growth factor, NGF), в культуре клеток вызывают дифференцировку клеток-предшественниц в симпатические нейроны.
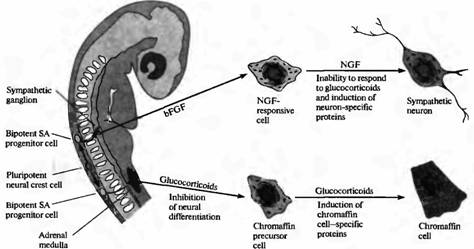
|
| Рис. 6. Определение направления развития клеток нервного гребня, образующих симпатоадреналовую (SA) систему. Плюрипотентные клетки нервного гребня образуют бипотентные SA клетки-предшественники. Судьба SA клеток-предшественников зависит от сигналов извне. SA клетки-предшественники, которые мигрируют в область надпочечника, подвергаются влиянию глюкокортикоидов, ингибирующих нервную дифференцировку и способствующих дифференцировке их в хромаффинные клетки. Альтернативным образом, SA клетки-предшественницы, которые мигрируют в область развивающейся симпатической цепочки, подвергаются воздействию основного фактора роста фибробластов, который приводит к экспрессии ФРН в SA предшественниках. Последующее действие ФРН приводит к тому, что клетки, нечувствительные к дифференцировке в ответ на глюкокортикоиды, начинают дифференцироваться в симпатические нейроны. |
|
|
|
Таким образом, фенотип клеток нервного гребня может быть определен после того, как они мигрировали прочь от нервной трубки, при помощи факторов, находящихся на периферии.
Выбор трансмиттера
При пересаживании клеток нервного гребня в относительно раннем периоде их дальнейшее развитие может изменяться вплоть до того, что они могут в дальнейшем использовать абсолютно другой трансмиттер, например ацетилхолин, вместо норадреналина. В некоторых случаях такая смена медиатора происходит в ходе нормального развития. Например, симпатические нейроны, иннервирующие потовые железы, изначально синтезируют норадреналин, но в период между второй — третьей неделями постнатального развития факторы, выделяемые железой, приводят к тому, что они начинают вырабатывать ацетилхолин. На более поздних стадиях клетки нервного гребня становятся уже слишком зрелыми и теряют способность менять свою дифференцировку в соответствии с изменениями окружающей среды.
Изучение механизма смены трансмиттера проводилось на культурах клеток симпатических ганглиев. Когда нейроны выделялись из верхнего шейного ганглия новорожденного крысенка и вырашивались в культуре в отсутствие клеток других типов, они все содержали фермент тирозингидроксилазу, синтезировали и образовывали запасы катехоламинов.
| Рис. 7. Отдельные нейроны симпатических ганглиев способны выделять как ацетилхолин, так и норадреналин в синапсах на культуре клеток сердца. (А) Микрокультура, содержащая отдельные симпатические нейроны, выращенные на островке клеток сердечной мышцы. (В) Короткая серия импульсов в нейроне (10 Гц, показано в виде отклонений нижней записи) вызывает ингибирование спонтанной активности миоцита из-за высвобождения АХ (верхняя запись). (С) Добавление атропина (10--7 М) блокирует тормозный холинергический ответ, что приводит к проявлению возбуждающего эффекта, вызванного высвобождение норадреналина. | 
|
|
|
|
Однако, если нейроны вырашивались в присутствии определенных типов ненейрональных клеток, таких как клетки сердечной мышцы или потовых желез, нейроны постепенно переставали синтезировать катехоламины и начинали синтезировать вместо этого фермент холинацетилтрансферазу и ацетилхолин. Для того, чтобы окончательно установить, что подобные изменения возможны в одиночных нейронах, они культивировались на микроостровках клеток миокарда (рис. 7). Нейроны быстро вытягивали свои отростки и образовывали синаптические контакты с клетками миокарда. Сначала эти синапсы были чисто адренергическими, затем, по прошествии нескольких дней, клетки начинали выделять вместе норадреналин и ацетилхолин. В конечном счете передача становилась полностью холинергической.
Фактор, который вызывал холинергическую дифференцировку симпатических нейронов, был выделен из среды клеток сердца и клонирован. Оказалось, что это фактор ингибирующий развитие лейкемии (leukemia inhibitory factor, LIF), белок, который ранее был описан по его способности индуцировать дифференцировку клеток иммунной системы. Два других близких цитокина, цилиарный нейротрофический фактор (ciliary neurotrophic factor, CNTF) и кардиотрофин-1, как было обнаружено, вызывают сходные эффекты в культуре нейронов. Все эти три фактора активируют рецепторный комплекс (называемый LlFR/3-gpl30 рецептор), блокирование которого угнетает развитие холинергических свойств нейронов, культивируемых вместе с клетками потовых желез. Однако иннервация потовых желез у мутантных мышей, не имеющих L1F и CNTF, формируется нормально, а результаты других экспериментов заставляют предположить, что кардиотрофин-1 не является фактором, который может вызывать переключение в клеточной иннервации потовых желез in vivo. Хотя еще не описано генетическое выключение всех трех генов, вполне возможно, что скоро будет описан новый, еще не идентифицированный фактор потовых желез, являющийся лигандом для LIFR-gpl30 рецептора.
|
|
|
Литература:
1. Rekling, J. C., and Feldman, J. L. 1998. Pre-Botzinger complex and pacemaker neurons: Hypothesized site and kernel for respiratory rhythm generation. Ann. Rev. Physiol 60: 385-405.
2. Thach, W.T., Goodkin, H.G., and Keating, J.G. 1992. The cerebellum and the adaptive coordination of movement. Annu. Rev. Neurosci. 15: 403-442.
3. Wichmann, T., and DeLong, M.R. 1996. Functional and pathophysiological models of the basal ganglia. Curr. Opin. Neurobiol. 6: 751-758.
|
|
|


