 |
Стероидные гормоны надпочечников
|
|
|
|
Кора надпочечников служит главным источником глюкокортикоидных и минералокортикоидных стероидных гормонов и в меньшей степени половых стероидных гормонов. Корковое вещество разделяется на три зоны, которые можно различить по морфологическому виду клеток и продуцируемым ими стероидным соединениям. Самый наружный слой коры — клубочковая зона — является местом синтеза минералокортикоидов, из которых наибольшее функциональное значение у человека и крысы имеют соответственно альдостерон и кортикостерон. Клетки средней зоны — пучковой — продуцируют глюкокортикоиды кортизол и кортизон. Самый внутренний слой — сетчатая зона — также принимает участие в синтезе глюкокортикоидов и, кроме того, как считают, производит небольшое количество стероидных половых гормонов андрогенов и эстрогенов. Главными источниками стероидных половых гормонов, однако, служат половые железы, и продукции половых гормонов корой надпочечников придают функциональное значение только в необычных условиях, когда на путях биосинтеза в надпочечных железах появляются дефекты ферментов. Функциональное подразделение биосинтетической активности коры надпочечников по анатомическим областям основано на результатах гистологических и гистохимических исследований этой ткани после «удаления» ее специфических стимуляторов. Гипофизэктомия и вызываемое ею отсутствие АКТГ приводят к атрофии пучковой и сетчатой зон, тогда как в клубочковой зоне появляются очень небольшие изменения. В то же время хроническая нагрузка натрием вызывает избирательную атрофию клубочковой зоны. Наоборот, при длительной стимуляции АКТГ или ограничении потребления натрия возникает соответственно гипертрофия пучковой и сетчатой или клубочковой зоны. Как будет показано далее, некоторые специфические ферменты, необходимые для образования минерале- и глюкокортикоидов, обнаруживаются только в специфических зонах коркового слоя надпочечников.
|
|
|
СТАДИИ БИОСИНТЕЗА
Биосинтез стероидных гормонов проходит сложную последовательность контролируемых ферментами этапов (рис. 3—17 [37, 38]. Ближайшим химическим предшественником надпочечниковых стероидов является холестерин, который не только поглощается клетками коры надпочечников из крови, но и образуется внутри этих клеток. Синтез холестерина начинается с ацетил-СоА и проходит через ряд промежуточных продуктов. Точное соотношение поглощенного из крови и образованного в самих клетках холестерина неизвестно, но, по-видимому, оба процесса играют существенную роль в обеспечении биосинтеза стероидных гормонов необходимым субстратом. Холестерин, будь то поглощенный из крови или синтезированный в коре надпочечников, накапливается в цитоплазматических липидных каплях (см. раздел, посвященный клеточному пути биосинтеза). Затем в митохондриях холестерин превращается в прегненолон путем образования вначале 20а-оксихолестерола, потом 20а, 22-диоксихолестерола и, наконец, расщепления цепи между 20-м и 22-м углеродным атомом с образованием прегненолона. Считается, что превращение холестерина в прегненолон является ограничивающим скорость этапом биосинтеза стероидных гормонов и что именно этот этап контролируется стимуляторами надпочечников: АКТГ, калием и ангиотензином II. В отсутствие стимуляторов надпочечники образуют очень мало прегненолона и стероидных гормонов. Прегненолон трансформируется в глюко-, минералокортикоиды и половые гормоны тремя разными ферментативными реакциями. Основной путь, наблюдаемый в пучковой зоне, включает дегидрирование 3|3-гидроксильной группы прегненолона с образованием прегн-5-ен-3,20-диона, который затем подвергается изомеризации в прогестерон. В результате серии гидроксилирований прогестерон превращается в 17а-оксипрогестерон под влиянием системы 17а-гидроксилазы, а затем в 17а, 21-диоксипрогестерон (17a-оксидезоксикортикостерон, 11-дезоксикортизол, соединение S) и, наконец, в кортизол в ходе 11b-гидроксилирования (соединение F). У крыс главным глюкокортикоидом, синтезируемым в коре надпочечников, является кортикостерон; небольшое количество кортикостерона продуцируется и в коре надпочечников человека. Путь синтеза кортикостерона идентичен таковому кортизола, за исключением лишь отсутствия этапа 17а-гидроксилирования. Альдостерон образуется из прегненолона в клетках клубочковой зоны путем, отличающимся от пути синтеза кортизола несколькими моментами. Клубочковая зона не содержит 17a-гидроксилазы и поэтому лишена способности синтезировать кортизол. Вместо него образуется кортикостерон, часть которого под действием 18-гидроксилазы превращается в 18-оксикортикостерон и затем под действием 18-оксистероиддегидрогеназы — в альдостерон. Поскольку 18-оксистероиддегидрогеназа обнаружена только в клубочковой зоне, считается, что и синтез альдостерона ограничен этой зоной.
|
|
|
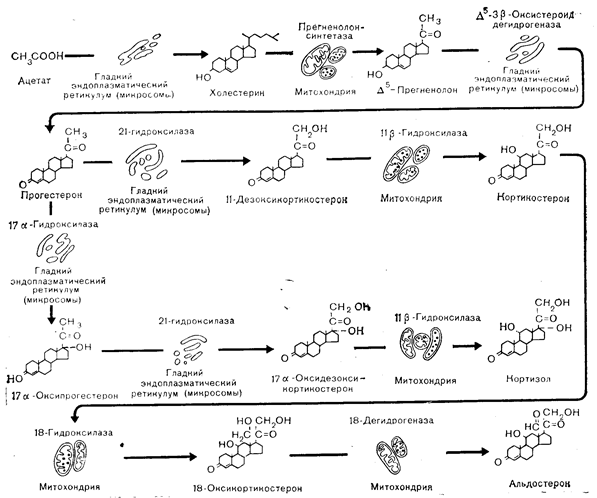
Рис. 3 — 17. Схематическое изображение внутриклеточного процесса биосинтеза кортикостероидов в надпочечниках. Следует обратить внимание на точку разветвления путей после образования прогестерона, в которой начальное 21-гидроксилирование приводит к образованию минералокортикоидов (кортикостерон, альдостерон), а 17-гидроксилирование — к образованию глюкокортикоидов (кортизол) [Malamed, 39].
Хотя главными физиологически значимыми стероидными гормонами, продуцируемыми корой надпочечников, являются кортизол и альдостерон, эта железа образует и небольшие количества андрогенов и эстрогенов, синтезируемых 3-м путем, в ходе которого 17,20-десмолаза превращает 17-оксипрогненолон и 17а-окси-ирогестерон в слабые андрогены дегидроэпиандростерон и D4-андростендион соответственно. Небольшие количества этих андрогенов превращаются в андрост-4-ен-3,17-дион и тестостерон. По всей вероятности, из тестостерона образуются также небольшие количества эстрогена 17бета-эстрадиола.
|
|
|
В норме превращение прегненолона в конечные продукты — кортизол, альдостерон, кортикостерон и дегидроэпиандростерон — происходит столь быстро, что эти продукты (но ни один из интермедиатов) являются единственными, которые накапливаются в количествах, достаточных для обеспечения физиологически значимой секреции.
Различные ферменты, принимающие участие в биосинтезе стероидов, можно разделить на три класса: гидроксилазы и лиазы (отщепляющие боковые цепи), требующие кислорода и НАДФ-Н; дегидрогеназы, которые используют НАД+ в качестве акцептора водорода и катализируют обратимые реакции; изомеразы, коферменты которых не идентифицированы. Гидроксилазы включают в себя несколько белков; они идентифицированы как ФАД-со держащий флавопротеин, негемовый железопротеин — адренодоксин и протопорфирин, гемопротеин — цитохром Р-450.
Источником восстановительной энергии для гидроксилирования является НАДФ-Н. В митохондриях и гладком эндоплазматическом ретикулуме, по-видимому, происходят близкие мультикомионентные реакции гидроксилирования. Однако компоненты систем в органеллах обоих типов различаются. В митохондриях для переноса электронов на цитохром С или цитохром Р-450 необходим как специфический флавопротеин, так и адренодоксин. В эндоплазматическом ретикулуме главным участником переноса электронов является другой флавопротеин, непосредственно восстанавливающий цитохром С; перенос же электронов на цитохром Р-450 облегчается, по-видимому, фосфолипидом.
Следует отметить существование врожденных клинических состояний, обусловленных дефицитом одного или нескольких ферментов, участвующих в реакциях биосинтеза. В этих условиях скорость ограничивающим становится тот этап биосинтетического процесса, который катализируется дефицитным ферментом, причем накапливаются и секретируются в избыточных количествах предшественники (субстраты) замедленной реакции. В настоящее время выяснены следующие клинические формы этих состояний дефицит 2-гидроксилазы (встречается чаще всего), сочетание дефицита 21-гидроксилазы с дефицитом 18-гидроксилазы, дефицит 11-гидроксилазы и 17-гидроксилазы. Еще две формы являются следствием дефицита либо 3b-оксистероид-дегидрогеназы, либо 18-оксидегидрогеназы. Все эти ферментные блоки приводят к недостаточной продукции и секреции кортизола — наиболее важного регулятора выделения АКТГ по принципу обратной связи. В результате уровень АКТГ в крови резко повышается и кора надпочечников становится объектом интенсивной стимуляции. Развивается выраженная гиперплазия ее. Продукция стероидов, образующихся проксимальнее заблокированного этапа процесса биосинтеза, увеличивается во много раз и достигает патологического уровня. Например, при недостаточности активности 21-гидроксилазы вследствие дефицита кортизола и альдостерона возникают гипогликемия и потеря соли, а вследствие избыточной продукции слабых андрогенов — дегидроэпиандростерона и D4-андростендиона — развивается выраженная вирилизация. Лечение кортизоном или кортизолом приводит к подавлению секреции АКТГ и снижению количества секретируемых надпочечниковых андрогенов.
|
|
|
Некоторые вещества оказывают избирательное ингибиторное действие на ферменты стероидогенеза. Метиранон, 2-метил-1,2-ди-3-пиридил-1-пропанон (SU 4885), снижает или полностью ингибирует 11b-гидроксилазу, что приводит к снижению секреции кортизола и одновременному увеличению секреции дезоксикортикостерона и 11-дезоксикортизола вследствие увеличения секреции АКТГ. Доказана большая клиническая польза метирапонового теста на функциональную целостность надпочечниково-гипофизарной оси; адекватное повышение уровня 11-дезоксикортизола в крови или 17-оксистероидных метаболитов в моче после введения этого вещества является веским доказательством сохранения функции как коры надпочечников, так и гипофиза. Аминоглютетимид (2-этил-2-аминофенил глютарамид) тормозит превращение холестерина в 20a-оксихолестерол; это приводит к накоплению холестерина в коре надпочечников и ингибированию синтеза кортикоидов. Соединение 1,1-дихлор-2-(о-хлорфенил)–2-(р -хлорфенил)-этан (о, р -ДДД) вызывает дегенеративные изменения именно в митохондриях надпочечников, вследствие чего тормозится секреция адренокортикостероидов. Механизм действия этого вещества сводится, по-видимому, к широкому угнетению активности многих ферментов коры надпочечников. Как аминоглютетимид, так и о, р -ДДД с определенным успехом применяются в лечении карциномы коры надпочечников.
|
|
|

Рис. 3—18. Часть адренокортикальной клетки крысы. а — ЛК — липидная капля: М — митохондрия; ГЭР — гладкий эндоплазматический ретикулум; ПМ — плазматическая мембрана. Следует обратить внимание на скудность шероховатого эндоплазматического ретикулума. х21 000; б — круглые структуры в матриксе митохондрий — это срезы через пузырьки и в некоторых случаях— через трубочки. Стрелками показаны взаимосвязи между трубочками и/или пузырьками (см. рис. 3—19) (Malamed). Электронная микрофотография. х42 700.
|
|
|


