 |
Субклеточная морфология клеток, секретирующих белковые гормоны
|
|
|
|
В значительной мере благодаря работам Palade и сотр. [3] было получено много сведений относительно морфологии путей используемых клеткой,. синтезирующей белки на экспорт. Некоторые субклеточные морфологические особенности свойственны различным белоксекретирующим клеткам. Такие клетки содержат множество окруженных мембранами органелл: эндоплазматический ретикулум, пластинчатые комплексы (аппараты Гольджи) и варьирующее число секреторных гранул (рис. 3—2, 3—3). Белки, предназначенные для секреции, попадают в эти субклеточные органеллы и транспортируются в них.
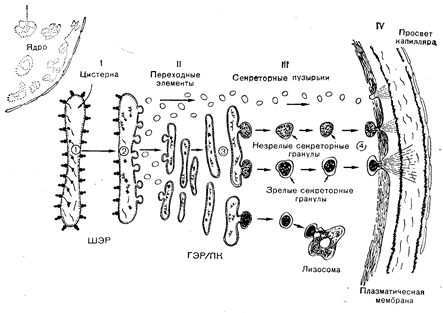
Рис. 3—3. Схема субклеточного транспорта и секреторного пути в белоксекретирующей клетке.
I — синтез белка на полирибосомах, прикрепленных к эндоплазматическому ретикулуму, и направленный выход через мембрану в цистернальное пространство: II— образование челночных пузырьков (переходные элементы) из эндоплазматического ретикулума, сменяемое их транспортом и включением в пластинчатый комплекс (ПК); III — образование секреторных гранул в ПК; IV — транспорт секреторных гранул к плазматической мембране, слияние с плазматической мембраной и экзопигоз, приводящий к выделению содержимого гранул во внеклеточное пространство. Можно видеть, что секреция способна осуществляться путем транспорта секреторных пузырьков, а также незрелых и зрелых гранул. Некоторые гранулы захватываются лизосомами и разрушаются (кринофагия). ШЭР — шероховатый эндоплазматический ретикулум; ГЭР — гладкий эндоплазматический ретикулум.
Секретируемые белки синтезируются на шероховатом эндоплазматическом ретикулуме (ШЭР), состоящем из полирибосом, прикрепленных к сложно устроенным мембранным мешочкам, содержащим цистерны. Вновь синтезированные белки быстро получают доступ в цистерны за счет транспорта через двойной слой липидов мембраны. По цистернам эндоплазматического ретикулума белки транспортируются в пластинчатый комплекс либо путем прямого переноса через цистерны, которые продолжаются в мембранные каналы пластинчатого комплекса, либо с помощью совершающих челночные движения пузырьков, называемых переходными элементами (см. рис. 3—3). Разные секреторные клетки, по-видимому, преимущественно используют тот или другой механизм транспорта белка из ШЭР в пластинчатый комплекс. В комплексе происходит упаковка белков в секреторные пузырьки и/или секреторные гранулы. Окруженные мембраной секреторные пузырьки отпочковываются от пластинчатого комплекса в виде незрелых гранул, подвергающихся по мере уплотнения белкового содержимого созреванию. Высвобождение белка во внеклеточное пространство происходит путем миграции секреторных гранул на периферию клетки и слияния мембраны, покрывающей гранулы, с плазматической мембраной (экзоцитоз), что и приводит к выходу белков из клетки.
|
|
|
Хотя это окончательно и не доказано, но некоторые биологи считают, что секреция белковых гормонов может происходить также путем внутриклеточного транспорта и высвобождения белков, содержащихся в секреторных пузырьках и незрелых секреторных гранулах (см. рис. 3—3) [3L Если такие альтернативные-пути секреции действительно существуют в дополнение к механизму образования и экзоцитоза зрелых гранул, то возникает возможность того, что разные внеклеточные стимулирующие факторы отличаются друг от друга своей сравнительной эффективностью в отношении модуляции секреции гормона тем или иным путем. Например, можно было бы предположить, что секреция инсулина, вызываемая глюкозой, с одной стороны, и кальцием или b-адренергическими агонистами — с другой, осуществляется различными секреторными путями, или что часть секреции паратиреоидного гормона, не подавляемая повышенным уровнем внеклеточного кальция, высвобождается путем, морфологически отличающимся от кальцийчувствительного пути.
|
|
|
ПУТЬ БИОСИНТЕЗА
Значительный интерес вызвало открытие синтеза белковых и полипептидных гормонов в виде более крупных предшественников, которые затем путем расщепления модифицируются в более мелкие (рис. 3—4) [4]. На самом деле белковые и полипептидные гормоны составляют только один из многих классов белков, синтезируемых как предшественники. В качестве примеров белков. различных классов могут служить сывороточный альбумин, протеины яичного белка, антитела, коллаген, ферменты поджелудочной железы, вирусные и связанные с мембранами белки. Усилия исследователей в настоящее время сфокусированы на выяснении физиологической роли биосинтетических предшественников на пути образования гормонов, а также общего значения предшественников секретируемых белков.
Одна из вероятных функций последовательности предшественников видна на примере инсулина. С-пептид проинсулина — соединительный пептид, связывающий А- и В-цепи инсулина — принимает участие, по-видимому, в правильной сборке цепей, создавая возможность эффективного образования дисульфидных связей. Такая стабилизирующая функция должна иметь место только применительно к ограниченному числу секретируемых белков, таких, как инсулин, поскольку многие белки существуют в виде одиночных полипептидных цепей, лишенных дисульфидных мостиков.

Рис. 3—4. Неполный перечень пребелков различных структурных классов.
Стрелками показаны участки расщеплений, в результате чего предшественники превращаются в промежуточные или окончательные продукты. Не все предшественники для превращения в промежуточные формы пробелков проходят через стадию расщепления (Habener, Potts [4]).
В настоящее время складываются представления в пользу вероятной роли предшественников в посттрансляционных процессах, обусловливающих внутриклеточный транспорт и компартментализацию гормонов по ходу секреторного пути [5, 6]. Эта гипотеза, известная под названием сигнальной, предложена Mistein и сотр. [5], а также Blobel и Sabatini [6] для объясневия молекулярного механизма, с помощью которого белки, предназначенные для секреции из клетки, избирательно получают доступ к окруженным мембранами субклеточным органеллам, участвующими в их транспорте, упаковке и секреции.
|
|
|
На основании модели, приведенной на рис. 3—5, можно объяснить путь биосинтеза паратиреоидного гормона как представителя полипептидных гормонов с учетом положений сигнальной гипотезы. Этот путь включает последовательное расщепление биосинтетических предшественников: препропаратиреоидный гормон (пре-про-ПТГ) ® пропаратиреоидный ® паратиреоидный гормон. Инициация синтеза белка происходит на полирибосомах в матриксе клетки. Инициальная аминокислота (аминокислоты) — метионин, кодируемая специфическим кодоном АУГ, отделяется от растущей полипептидной цепи, когда она достигает в длину примерно 20—30 аминокислот (примерная длина полипептида, покрывающая протяженность крупной рибосомальной субъединицы). Этот процесс считается общим для синтеза всех белков, продуцируемых эукариотами.
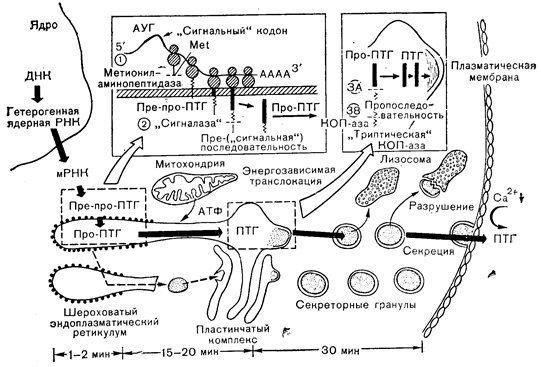
Рис. 3—5. Схематическое изображение пути биосинтеза паратиреоидного гормона.
КОПаза—карбоксипептидаза В (Habener, Potts [4]),
Гидрофобная специфическая для прегормона последовательность пре-про-ПТГ, кодируемая последовательностью оснований мРНК, непосредственно прилегающей (3 -конец) к инициальному кодону АУГ (сигнальные кодоны), выступает затем в роли «водителя» или сигнала, который каким-то, до сих пор не выясненным, образом обеспечивает контакт комплекса полирибосома — синтезируемая цепь с мембраной эндоплазматического ретикулума. Контактируя с этой мембраной либо за счет чисто гидрофобных взаимодействий, либо, что вероятнее, за счет специфических рецепторов мембраны, растущая полипептидная цепь проходит через мембрану во внутрицистернальное пространство. Сразу же после этого или, вероятно, еще в процессе прохождения пре-про-ПТГ в цистерну сигнальная последовательность отщепляется, по-видимому, под действием специфической пептидазы, локализованный в эндоплазматическом ретикулуме, что приводит к образованию про-ПТГ. Этот промежуточный предшественник (про-ПТГ) движется затем по каналам, образованным мембранами эндоплазматического ретикулума, в пластинчатый комплекс, где от него под сочетанным действием ферментов, обладающих активностью, сходной с активностью трипсина и карбоксипептидазы В, отщепляется МНа-концевой гексапептид. Окончательный гормональный продукт включается в секреторные гранулы и высвобождается во внеклеточное пространство в ответ на снижение концентрации кальция во внеклеточной жидкости.
|
|
|
Правильность этой модели подтверждается многими данными» [7—11]. При структурном анализе первичных продуктов трансляции некоторых мРНК, кодирующих различные секретируемые белки, было обнаружено, что многие, если не все, белковые гормоны и секретируемые белки синтезируются вначале в виде предшественников с гидрофобными N1-12-концевыми участками (см. рис. 3—4). По-видимому, препропаратиреоидный гормон [12] является типичным представителем целого класса биосинтетических предшественников (пребелков) белковых гормонов, к которым относятся инсулин, СТГ, пролактин, ТТГ и АКТГ, а также негормональных секретируемых белков, таких, как ферменты поджелудочной железы, протеины яичного белка, иммуноглобулины, сывороточный альбумин, «мелиттин» (или меллитин — пчелиный яд) и некоторые ассоциированные с мембраной бактериальные белки. Характерным для сигнальных последовательностей предшественников является то, что они расположены на NH2-концевой части белков. Эти последовательности различаются по длине, включая от 15 до 25 аминокислотных остатков; в центральных их частях содержится гидрофобный участок, состоящий из 10— 12 аминокислот. Столь высокая степень гидрофобности характерна для белков, известных своим специфическим взаимодействием с мембранами.
Приведенные данные позволяют считать, что обеспечение возможности движения через мембрану — основная функция сигнальной последовательности. Таким образом, благодаря специфическому характеру последовательности предшественника из множества клеточных белков отбираются, отделяются, транспортируются и поступают на секреторный конвейер клетки белки, предназначенные для секреции.
Если в отношении прегормонов или препрогормонов существуют веские доказательства их транспортной функции, то функция промежуточных предшественников—прогормонов—остается неизвестной. Радиоавтографические исследования миграции вновь синтезированных белков в клетке показали, что превращение прогормона в конечные продукты происходит в пластинчатом комплексе клетки. Например, период в 15 мин между началом сип-теза пре-про-ПТГ и первым появлением ПТГ практически совпадает со сроком, необходимым для попадания радиоавтографических гранул в пластинчатый комплекс [13]. Превращение прогормона в гормон может быть также избирательно заблокировано действием на ткани ингибиторов продукции энергии в клетке (антимицин А и динитрофенол), равно как и веществами, нарушающими функцию микротрубочек (винбластин и колхицин). Эти данные указывают на то, что транслокация прогормона из ШЭР в пластинчатый комплекс является энергозависимым процессом, и что в движении прогормона могут принимать участие микротрубочки. Однако отсутствуют прямые доказательства того, что прогормон сам по себе, или его химические взаимодействия, играет существенную роль в транспорте вновь синтезированного белка из ШЭР в пластинчатый комплекс или что он в какой-либо мере определяет упаковку гормона в пузырьки или гранулы. Недавно проведенные исследования, согласно которым синтез многих секретируемых белков не требует образования промежуточных, или проформ предшественников (см. рис. 3—4), порождают определенные сомнения в справедливости такого представления [4]. Непонятно, почему некоторые секретируемые белки, например паратиреоидный гормон, инсулин и сывороточный альбумин, образуются с помощью промежуточных предшественников, тогда как другие, например СТГ, пролактин и овальбумин, не проходят через эту стадию.
|
|
|
Если значение прогормона для клеточного транспорта не известно, то некоторые детали его расщепления уже изучены. В отличие от того, что наблюдается в отношении прегормонов, в которых аминокислотные остатки по месту отщепления сигнальной последовательности от остальной части молекулы (гормона или прогормона) в разных прегормонах неодинаковы (см. рис. 3—4 и 3—5), места расщепления пробелковых интермедиатов постоянно содержат основные аминокислоты лизин или аргинин (или и ту и другую), обычно по 2—3 вместе (см. рис. 3—4). Этот субстрат легко и предпочтительно атакуется эндопептидазами, обладающими трипсиноподобной активностью. После эндопептидазного расщепления оставшиеся основные аминокислоты подвергаются избирательному отщеплению под действием экзопептидаз с активностью, подобной активности карбоксипептидазы В.
Вполне вероятно, что все пробелки расщепляются в ходе общего ферментативного процесса внутри пластинчатого комплекса клеток различного происхождения. Однако роль этого общего процесса расщепления прогормонов, находящихся на секреторном конвейере, остается неизвестной, как и значение самого существования пробелковых интермедиатов некоторых, но не всех, секретируемых белков. Дальнейшее ферментативное расщепление пептида-предшественника, отделившегося от пропаратиреоидного гормона, может представлять собой один из этапов клеточной деградации этого пептида, или, что более вероятно, трипсиноподобная и карбоксипептидазо-В-подобная активности могут быть неразделимыми свойствами единого ферментного комплекса. Не исключено также, что части пептидов-предшественников, отщепляемые от пробелка, могут обладать пока не установленной собственной и самостоятельной биологической активностью, а их дальнейшее расщепление необходимо для проявления этой активности. Такая ситуация, вероятно, складывается в процессе образования АКТГ, b-липотропина и эндорфинов (опиатоподобные пептиды), которые одновременно появляются в результате расщепления общего крупного белкового предшественника [14].
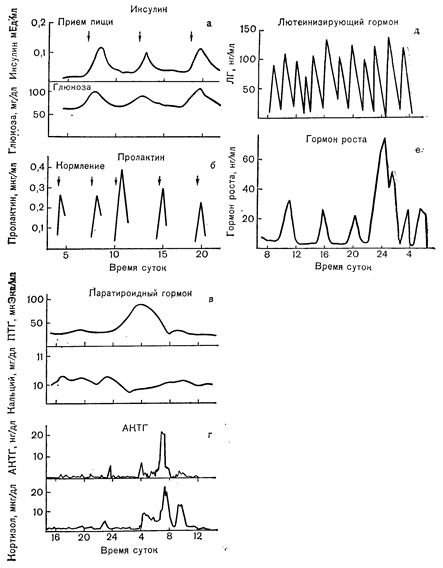
Рис. 3—6, Особенности секреции различных белковых гормонов. Секреция в ответ на специфические внешние стимулы (а, б); циркадный ритм секреции (в, г); «спонтанная» секреция, предположительно возникающая под влиянием ЦНС (д, е) (в— Jubiz W. и соавт., J. Cim. Invest.» 1972, 51, 2040; r—Gallager T.F. и соавт., J. din. EndocrinoL Metab., 1973, 36, 1058; д— Yen S.S. С. и соавт., J. din. EndocrinoL Metab., 1972, 34, 671; е — Finkelstein J.W. и соавт., J. Clin. EndocrinoL Metab., 1972, 35, 665).
СЕКРЕЦИЯ И РЕГУЛЯЦИЯ
Секреция белковых и полипептидных гормонов контролируется высокоспецифическими внеклеточными стимулами. В большинстве случаев такие стимулы представляют собой изменения уровня циркулирующих в крови веществ, что должно было бы привести к нарушению гомеостатического равновесия, а гормональные продукты, высвобождаемые вследствие этих изменений, действуют на соответственные органы-мишени, в результате чего восстанавливается гомеостаз (рис. 3—6). Например, повышение после приема пищи количества глюкозы в крови стимулирует секрецию инсулина, который в свою очередь стимулирует поглощение глюкозы мышцами, в связи с чем содержание глюкозы в крови нормализуется. Другим примером служит стимуляция высвобождения паратиреоидного гормона уже небольшим снижением уровня кальция в крови. Выделившийся при этом паратиреоидный гормон действует на свои органы-мишени — костную ткань и почки, способствуя обратному поступлению кальция во внеклеточную жидкость. Эти регуляторные процессы включают и ингибиторную петлю обратной связи, в силу которой продукты, вырабатываемые органами-мишенями и выделяемые в кровоток в ответ на действие гормонов, тормозят его дальнейшую секрецию. Например, снижение уровня глюкозы в крови тормозит дальнейшую секрецию инсулина, а увеличение содержания кальция в крови тормозит высвобождение паратиреоидного гормона. Большое число регуляторных петель обратной связи может действовать согласованно, что, например, наблюдается в отношении физиологической регуляции секреции различных гормонов передней долей гипофиза (рис. 3—7). В некоторых случаях точная природа стимула, участвующего в регуляции секреции гормона, выяснена недостаточно полно; эта неопределенность касается, например, «факторов», ответственных за «вспышки» секреторной активности, проявляемой передней долей гипофиза, и контролирующих элементов, управляющих циркадными или суточными ритмами.

Рис. 3—7. Регуляторные петли обратной связи в гипоталамо-гипофизарной системе. Такая регуляция может быть показана на примере любого из гипофизарных гормонов, в частности ТТГ, ЛГ, ФСГ, пролактина, СТГ.
Окончательные детали молекулярных процессов сопряжения внеклеточных стимулов с секрецией гормона и в конце концов с биосинтезом нового гормона, необходимого для восполнения его количества в железе, неизвестны. В известных же случаях эти процессы в разных клетках, секретирующих белковые гормоны, могут быть различными. Имеются, однако, данные о том, что в секреции многих гормонов может принимать участие общий механизм сопряжения. Этот механизм в качестве 2-го медиатора использует цАМФ (рис. 3—8). Согласно данной модели, стимулирующий фактор не проникает в клетку, а взаимодействует с рецептором, расположенным в структурах плазматической мембраны. Каким-то образом при связывании с рецептором плазматической мембраны стимулирующий фактор активирует аденилатциклазу, что приводит к образованию 3,5-цАМФ, который в свою очередь превращает неактивную форму фосфорилирующего фермента — протеинкиназы в активную форму путем отсоединения регуляторной субъединицы (PC) от активной каталитической субъединицы (КС).
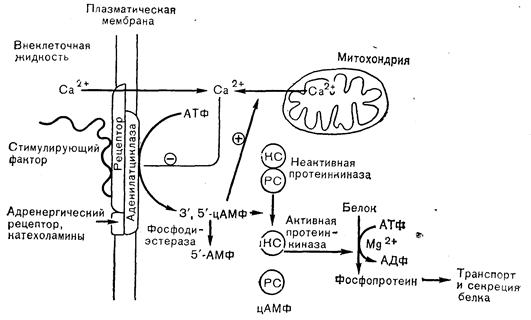
Рис. 3—8. Предполагаемый механизм действия полипептидных гормонов на клетку-мишень. KС — каталитическая субъединица; PC — регуляторная субъединица. Объяснения»
Протеинкиназа (активная субъединица) катализирует фосфорилирование определенных внутриклеточных белков, причем считается, что образующиеся таким образом фосфорилированные белки играют роль в процессах транспорта и секреции гормона, вероятно, путем активации микротрубочек и/или слияния мембран секреторных гранул с плазматической мембраной. В настоящее время из-за отсутствия экспериментальных доказательств перечисленных процессов они остаются в высшей степени гипотетическими. Действительно, о характере процессов и сил, участвующих во внутриклеточном продвижении белков, известно крайне мало.
Следует отметить важную роль кальция в секреторном процессе. Потоки кальция из внеклеточной жидкости в клетку, равно как и его потоки из внутриклеточных органелл (например, митохондрий) в цитозоль, тесно сопряжены с секреторными процессами. При дефиците кальция во внеклеточной жидкости секреция значительно тормозится. Возможно, что вход кальция в клетку каким-то еще не изученным образом связан с активацией аденилатциклазы.
На секрецию белковых гормонов многими эндокринными органами влияют и катехоламины, действующие через адренергические рецепторы, связанные с рецепторами, реагирующими на главные стимулы. Считают, что эти адренергические эффекты служат модуляторами секреторной активности, находящейся в основном под контролем главных стимулирующих факторов.
С секреторными процессами должны быть каким-то образом связаны процессы биосинтеза. Синтез новых молекул гормона необходим для пополнения потраченных и, наоборот, при уменьшении потребности в секреции должен был бы тормозиться и синтез новых молекул гормона, чтобы предотвратить перегрузку им клетки. Мало известно о клеточных механизмах, сопрягающих секреторные процессы с процессами биосинтеза, т. е. не ясно, непосредственно влияют внеклеточные факторы, регулирующие скорость секреции, на скорость биосинтеза гормона, или сам по себе процесс секреции обеспечивает появление регуляторных сигналов, передающихся на отдельные этапы биосинтеза. Степень сопряжения секреторной и биосинтетической активности в конкретной эндокринной железе в большой мере может определяться относительной величиной накопления гормонов в железе. Железы, обладающие сравнительно большим количеством гормона, могут удовлетворять потребность в секреции более длительное время, чем железы с меньшими запасами его. Судя по главному морфологическому признаку секреторных клеток — присутствию секреторных гранул, все эндокринные клетки в той или иной степени обладают запасом гормонов. Вероятно, такие запасающие системы возникли с целью придания эндокринным секреторным клеткам свойства буфера или резервуара гормона, который может быть мобилизован на удовлетворение секреторных потребностей в течение очень короткого времени, без включения механизмов острого изменения скорости биосинтеза гормона.
Конкретный этап (или этапы) процесса биосинтеза гормона, на котором осуществляется регуляция этого процесса, в настоящее время не известен. Согласно существующим представлениям (см. рис. 3—1), регуляция могла бы происходить на одном или нескольких уровнях; помимо синтеза ДНК (рост и деление клеток), эти уровни включают: 1—транскрипцию; 2—посттранскрипционные процессы; 3 — трансляцию; 4 — посттрансляционные процессы. Клеточный и молекулярный уровни регуляции биосинтеза большинства белковых гормонов идентифицированы далеко не в той степени, которая позволила бы сделать определенные заключения. Однако имеющиеся ограниченные сведения, касающиеся, например, биосинтеза паратиреоидного гормона, свидетельствуют о том, что главные объекты регуляторных влияний в ответ на изменение содержания кальция в крови локализуются на уровне деления клеток и/или транскрипционном этапе. Стимуляция железы в условиях снижения содержания кальция приводит, очевидно, к увеличению синтеза РНК и в конце концов к гиперплазии железы. В околощитовидной железе функционирует и 3-й регуляторный механизм на посттрансляционном уровне: изменение внутриклеточного кругоооборота гормона. Таким образом, до сих пор нет достаточно четких и убедительных данных, которые свидетельствовали бы о том, что внеклеточные стимулы могут быть ответственными за изменение скорости расщепления биосинтетических предшественников или скорости инициации и трансляции мРНК, кодирующих гормоны.
ТИРЕОИДНЫЕ ГОРМОНЫ
Клеточные и молекулярные механизмы, используемые щитовидной железой для биосинтеза, накопления и секреции тиреоидных гормонов в течение прошлых 3—4 десятилетий, изучены достаточно полно благодаря объединенным усилиям большого числа исследователей. Подробности этих исследований содержатся в ряде исчерпывающих обзоров. Синтез тиреоидных гормонов во многих. отношениях сходен с синтезом полипептидных и белковых гормонов с добавлением нескольких уникальных этапов, особенно подходящих к метаболическим функциям щитовидной железы.
Основными тиреоидными гормонами являются йодтиронины — тетрайод-L-тиронин (тироксин, Т4) и 3,5,3-трийод-L-тиронин (трийодтиронин, Т3), которые образуются из йодированных тирозиновых предшественников. Они состоят из йодтирозина (моно — или дийодированного) и йодированного фенольного кольца, объединенных 4,1-эфиpнoй связью (рис. 3—9). Эти два йодтиронина вместе с йодтирозиновыми предшественниками составляют примерно 90% органического или белковосвязанного йода в щитовидной железе, причем на долю Т4 и Т3 приходится 99% секретируемого органического йода. Процессы образования и секреции тиреоидных гормонов включают несколько этапов, часть которых отличается своеобразием и характерна только для щитовидной железы.
Главными веществами, используемыми в синтезе тиреоидных гормонов, являются йод и тирозин. Щитовидная железа отличается высокоэффективным механизмом захвата йода из крови, а в качестве источника тирозина она синтезирует и использует крупный гликопротеин — тироглобулин. Если тирозин в организме содержится в большом количестве и поступает как из пищевых продуктов, так и из распадающихся эндогенных белков, то йод присутствует лишь в ограниченном количестве и поступает только из пищевых продуктов. Йод всасывается из кишечника в форме йодида и в этой форме циркулирует в крови в свободном (несвязанном) состоянии.
Йодид, захватываемый из крови тиреоидными (фолликулярными) клетками, и тироглобулин, синтезируемый в этих клетках, секретируются (путем экзоцитоза) во внеклеточное пространство внутри железы, называемое просветом фолликула или коллоидным пространством, окруженное фолликулярными клетками. В просвете фолликула или (что более вероятно) на апикальной поверхности клеток, обращенной в этот просвет, йодид окисляется в йод и другие окисленные продукты и ковалентно связывается фенольными кольцами тирозиновых остатков, содержащихся в полипептидном каркасе тироглобулина. Связывание йода с фенольным кольцом происходит либо только в 3-м положении, либо как в 3-м, так и в 5-м положениях, в результате чего образуются монойодтирозин (МИТ) и дийодтирозин (ДИТ) соответственно. Этот процесс йодирования тирозиновых остатков тироглобулина известен под названием этапа органификации в биосинтезе тиреоидных гормонов.

Рис. 3—9. Структура некоторых тиреоидных гормонов (Ingbar S.Н., Woeber К.A. In: Textbook of Endocrinology/Ed. Williams R.H. Sth ed.— Philadelphia: Saunders, 1974).
Следующим этапом является конденсация йодтирозинов с образованием йодтиронинов. Все еще оставаясь в структуре тироглобулина, молекулы МИТ и ДИТ конденсируются, образуя трийодтиронин (Т3), и подобно этому две молекулы ДИТ конденсируются, образуя молекулу L-тироксина (Т4). В таком виде, т. е. связанные с тироглобулином, йодтиронины, равно как и непроконденсировавшие йодтирозины, хранятся в тиреоидном фолликуле. Этот комплекс йодированного тироглобулина часто называют коллоидом. Таким образом, тироглобулин, составляющий 10% от влажной массы щитовидной железы, служит белком-носителем, или предшественником накапливающихся гормонов.
Секреция тиреоидных гормонов — процесс, происходящий в ответ на метаболические потребности и опосредуемый действием тиротропного гормона (ТТГ) на тиреоидные клетки, — предполагает высвобождение гормонов из тироглобулина. Это происходит на апикальной мембране путем поглощения коллоида, содержащего тироглобулин (процесс, известный под названием эндоцитоза). Тироглобулин затем гидролизуется в клетке под влиянием протеаз, а высвобождаемые таким образом тиреоидные гормоны выделяются в циркулирующую кровь.
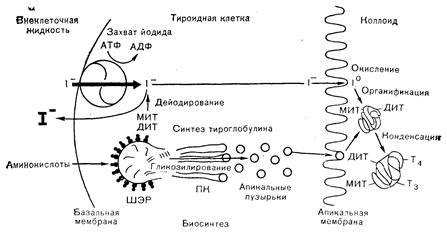
Рис. 3 — 10. Схематическое изображение пути биосинтеза тиреоидных гормонов в клетке. Т3 и Т4 образуются и хранятся связанными с тироглобулином в коллоиде.
ПК — пластинчатый комплекс: МИТ — монойодтирозин: ДИТ — дийодтирозин} ШЭР — шероховатый эндоплазматический ретикулум.
БИОСИНТЕЗ
Различные этапы биосинтеза и секреции тиреоидных гормонов L-трийодтиронина (Т3) и L-тироксина (Т4) следует рассмотреть отдельно и более подробно, подразделив их на следующие категории: 1 — биосинтез тироглобулина; 2 — захват йодида, 3 — органификация йодида; 4—конденсация; 5—поглощение клетками и протеолиз коллоида; 6 — секреция. Схематическое изображение различных этапов биосинтеза тероидных гормонов представлено на рис. 3—10.
Биосинтез тироглобулина
Тироглобулин представляет собой крупный гликопротеин с молекулярной массой примерно 670 000 (19S). Он состоит по меньшей мере из 4 субъединиц (из двух сходных пар разных субъединиц), связанных друг с другом комбинацией нековалентных и ковалентных.(дисульфидных) связей. Белковый комплекс содержит от 8 до 10% углеводов. Тироглобулин состоит примерно из 5900 аминокислотных остатков, около НО из которых—тирозиновые. Содержание йода в тироглобулине, полученном из интактных желез, колеблется от 0,2 до 1% и более. Тироглобулин синтезируется на полирибосомах, связанных с ШЭР (см. рис. 3—10). Субклеточный путь, по которому транспортируется вновь синтезированный тироглобулин, характерен для транспорта многих предназначенных к секреции белков. Вновь синтезированные полипептидные цепи направленно проникают через мембрану ретикулума во внутрицистернальное пространство ШЭР, по которому переносятся в пластинчатый комплекс и упаковываются в окруженные мембраной пузырьки, называемые апикальными пузырьками (см. рис. 3—10 и 3—11). Эти пузырьки транспортируются к апикальному краю клетки, где сливаются с мембраной, граничащей с фолликулярным, или коллоидным, пространством, и тироглобулин выбрасывается в это пространство [15, 16]. Именно на поверхности этой мембраны со стороны коллоида и йодируется тироглобулин (см. далее). Исследования с импульсной меткой и последующим ее разведением, проводимые на срезах щитовидной железы, инкубируемых с радиоактивными аминокислотами in vitro, показали, что процессы синтеза и транспорта тироглобулина (от момента начального синтеза до первого появления в коллоидном пространстве) занимают от 4 до 6 ч. Начальным продуктом синтеза является, по-видимому, субъединица с молекулярной массой около 160000 (3—8S). Предполагается, что разные субъединицы кодируются отдельными мРНК.
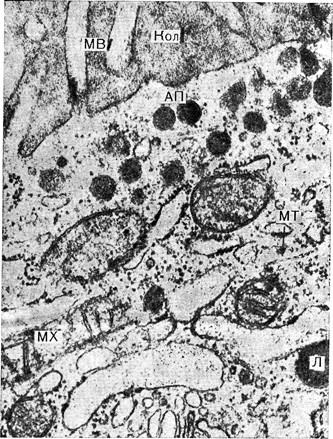
Рис. 3—11. Участок тиреоидной фолликулярной клетки. Вверху можно видеть микроворсинки (MB), тянущиеся от апикального края клетки в коллоид (Кол), в цитоплазме под краем—апикальные пузырьки (АП).
Плотное тельце, имеющее лизосомную (Л) природу; МТ — микротрубочки, MX — митохондрия Электронная микрофотография. х37 800 (Haddad А и соавт., J. Cellp Biol., 1971, 49, 856).
Затем субъединицы объединяются в димеры с молекулярной массой 320 000 (12S,) и образуют нейодированный тироглобулин (17S), который «созревает» во время и после йодирования в окончательный комплекс с молекулярной массой 667000 (19S). Последовательность такова: 4 субъединицы (по 3—8S) ® 2 субъединицы (по 12S) ® нейодированный («незрелый») тироглобулин (17S) ® йодированный («зрелый») тироглобулин (19S). Гликозилирование тироглобулина происходит на всех стадиях синтеза. Сердцевинный олигосахаридный комплекс присоединяется, вероятно, к отдельным аспарагиновым остаткам N-гликозидной связью и переносится с долихофосфатного носителя в ходе транспорта вновь образуемых цепей субъединиц через мембраны эндоплазматической сети. В процессе транспорта полипептида по цистернам эндоплазматического ретикулума в пластинчатый комплекс к олигосахаридным ядрам добавляются новые углеводные остатки. По всей вероятности, гликозилирование каким-то образом участвует в транспорте и сборке цепей субъединиц и необходимо для формирования полностью собранного тироглобулинового комплекса с его специфической трехмерной четвертичной структурой.
Захват йода
Важнейшим этапом биосинтеза тиреоидных гормонов является активный, контролируемый ферментами, транспорт йодида, содержащегося в крови, через мембрану тиреоидной клетки в цитозоль и из него в фолликулярный коллоид. В конечном счете обеспеченность организма йодом должна определяться пищевыми продуктами. Часть йода всасывается в органической форме и превращается в йодид в печени. Однако наибольшая его часть уже. всасывается в форме йодида и именно в этой форме разносится с кровью. Суточное потребление йодида с пищей в США составляет примерно 500 мкг. Из этого количества 120 мкг поглощается щитовидной железой и 60 мкг включается в тиреоидные гормоны и секретируется с Т4 и Т3. Поглощение и концентрирование йодида щитовидной железой обеспечивается двумя энергозависимыми контролируемыми ферментными «насосами», или механизмами захвата; один, расположенный на базальной, или капиллярной, мембране, извлекает йодид из крови и транспортирует его в цитозоль тиреоидной клетки, а второй, локализующийся на апикальной мембране, доставляет его в коллоидное пространство. Существует и конкурентный пассивный перенос йодида обратно в кровь, но «чистый» эффект сводится к концентрированию йодида в щитовидной железе. Эти насосы функционируют столь эффективно, что концентрация йодида в щитовидной железе не менее чем в 25 раз превышает его уровень в плазме крови, а в условиях дефицита йода концентрация йодида в железе может быть в 500 paз выше, чем в плазме. Эффективность, с которой щитовидная железа концентрирует йодид, находится в обратной зависимости от уровня доступного йодида в плазме, и в условиях относительной йодной недостаточности железа извлекает до 20% йодида, присутствующего в крови. Извлеченный тиреоидной клеткой из крови йодид быстро уравновешивается в общем пространстве йодида, уже содержащегося в клетке, который образуется в результате распада и дейодирования йодаминокислот, высвобождающихся из-тироглобулина (см. далее), и быстро проникает в коллоидное-пространство, где связывается с тироглобулином. Этот концентрирующий и транспортный механизм работает так быстро, что отношение «свободного» йодида к органически связанному в щитовидной железе может составлять лишь 10:8000 мкг. Авторадиографические исследования показали, что уже через 30 с после импульсного внутривенного введения животному радиоактивного йодида практически вся метка обнаруживается в коллоидном пространстве, будучи органически связанной с тироглобулином [17]; только около 0,25% тиреоидного йода остается в форме свободного йодида, а остальная его часть связана с тироглобулином в форме йодаминокислот или йодтиронинов.
О необходимости столь легкого накопления йода в щитовидной железе свидетельствует тот факт, что для поддержания нормальной секреции гормонов эта железа должна каждые сутки накапливать от 50 до 75 мкг йодида, т. е. полностью экстрагировать йодид из 20—30% крови, протекающей через щитовидную железу в сутки, что составляет лишь небольшую часть резерва, необходимого на случай колебаний содержания йода в диете или возникновения чрезмерной потребности в тиреоидных гормонах. Сам организм, однако, способен в значительной мере компенсировать временный дефицит йодида путем повышения его канальцевой реабсорбции и всасывания в кишечнике.
Детали конструкции йодидных насосов выяснены не полностью» но, по всей вероятности, в них участвует Na+/K+-стимулируемая, Mg2+-зависимая оуабаинчувствительная АТФаза. Для накопления йодида необходимы и ионы кальция. Процесс концентрирования явно зависит от доступности клеточной энергии, поскольку разобщители окислительного фосфорилирования, такие, как 2,4-динитрофенол и бис-оксикумарин, являются эффективными ингибиторами накопления йода срезами щитовидной железы.
Щитовидная железа концентрирует не только йодид, но и некоторые другие анионы, которые могут действовать как конкурентные ингибиторы транспорта йодида. К таким ингибиторам относятся тиоцианат, перхлорат и пертехнетат. Перхлорат можно применять в клинике для того, чтобы вызвать быстрый выброс неорганического йодида, после определения количества которого можно получить представление о величине несвязанной фракции йодида в щитовидной железе. У больных с нарушенной органификацией йодида, например при врожденном дефиците ферментов или воздействии зобогенных факторов, блокирующих органификацию йодида, одна и та же доза перхлората будет высвобождать гораздо большую, чем в норме, часть дозы ранее введенного»
|
|
|


