 |
IV.4. Применение тантала и ниобия
|
|
|
|
Рассматривая характер элемента и тех веществ, которые он образует, я уже обращала внимание на особенности, представляющие ценность для практического использования. Тантал, как и ниобий, применяется преимущественно в электровакуумной технике и химической промышленности. Однако все чаще и чаще мелькают в печати сообщения об использовании тантала наряду с ниобием в самолето- и ракетостроении, а вместе с тем, вероятно, и в космической технике.
Оба элемента обладают ценным сочетанием качеств. Способность поглощать газы хороша для поддерживания высокого вакуума: химическая инертность позволяет использовать их в высокоагрессивных средах, вплоть до атомных реакторов, и применять в медицине при костной и пластической хирургии. Металлы нисколько не вредят деятельности живых тканей организма. Настоящий переворот вызвало применение тантала, ниобия и их соединений в металлургии. Появилась возможность резко расширить ассоримент различных сталей и сплавов. Причем не только ниобий и тантал меняют характер сплавов, но и, наоборот, добавка к этим элементам других металлов придает им иные качества. Алюминий, например, повышает прочность металлического ниобия и тантала. Вольфрам и молибден увеличивают их теплостойкость. С добавлением меди увеличивается способность металлов проводить электрический ток. При этом сплав почти вдвое становится прочнее и тверже, чем медь.
Из тантала изготовляют фильеры для протяжки нитей в производстве искусственных волокон. Раньше такие фильеры делали из платины и золота. Самые твердые сплавы получают из карбида тантала с никелем в качестве цементирующей добавки. Они настолько тверды, что оставляют царапины даже на алмазе, который считается эталоном твердости.
|
|
|
За время, прошедшее после издания этой книги в 1973 г., накопилось немало новых данных о применении ниобия и тантала. Так, по сведениям, относящимся к январю 1975 г., первое место по величине критической температуры перехода в сверхпроводящее состояние было отдано германиду ниобия Nb3Ge. Его критическая температура составляет 23,2 К (примерно—250 °С). Другое соединение — станнид ниобия — становится сверхпроводником при немного более низкой температуре —255 °С. Чтобы полнее оценить этот факт, укажем, что большинство сверхпроводников известны лишь для температур жидкого гелия (2,172 К). Сверхпроводники из ниобиевых материалов позволяют изготавливать магнитные катушки, создающие чрезвычайно мощные магнитные поля. Магнит диаметром 16 см и высотой 11 см, где обмоткой служит лента из такого материала, способен создать поле колоссальной напряженностью. Необходимо только перевести магнит в сверхпроводящее состояние, т. е. охладить, а охлаждение до менее низкой температуры произвести, конечно, легче.
Важна роль ниобия в сварочном деле. Пока сваривали обычную сталь, никаких особых трудностей этот процесс не представлял и сложностей не создавал. Однако, когда начали сваривать конструкции из специальных сталей сложного химического состава, сварные швы стали терять многие ценные качества свариваемого металла. Ни изменения состава электродов, ни усовершенствование конструкций сварочных аппаратов, ни сварка в атмосфере инертных газов никакого эффекта не давали. Вот тут-то на помощь и пришел ниобий. Сталь, в которую как небольшая добавка введен ниобий, можно сваривать, не опасаясь за качество сварного (рис. 4) шва. Хрупкость шву придают возникающие при сварке карбиды, но способность ниобия соединяться с углеродом и препятствовать образованию карбидов других металлов, нарушающих свойства сплавов, спасли положение. Карбиды же самого ниобия, как и тантала, обладают достаточной вязкостью. Это особенно ценно при сварке котлов и газовых турбин, работающих под давлением и в агрессивной среде.,
|
|
|
 Ниобий и тантал способны поглотить значительные количества таких газов, как водород, кислород и азот. При комнатной температуре 1 г ниобия способен поглотить 100 см3 водорода. Но даже при сильном нагревании это свойство практически не слабеет. При 500°С ниобий еще может поглотить 75 см3 водорода, а тантал в 10 раз больше. Этим свойством пользуются для создания высокого вакуума или в электронных приборах, где необходимо сохранить точные характеристики при высоких температурах. Ниобий и тантал, нанесенные на поверхность деталей, как губка, поглощают газы, обеспечивая стабильную работу приборов. С помощью этих металлов больших успехов достигла восстановительная хирургия. В медицинскую практику вошли не только пластинки из тантала, но и нити из тантала и ниобия. Хирурги успешно используют такие нити для сшивания порванных сухожилий, кровеносных сосудов и нервов. Танталовая «пряжа» служит для возмещения мускульной силы. С ее помощью хирурги укрепляют после операции стенки брюшной полости.
Ниобий и тантал способны поглотить значительные количества таких газов, как водород, кислород и азот. При комнатной температуре 1 г ниобия способен поглотить 100 см3 водорода. Но даже при сильном нагревании это свойство практически не слабеет. При 500°С ниобий еще может поглотить 75 см3 водорода, а тантал в 10 раз больше. Этим свойством пользуются для создания высокого вакуума или в электронных приборах, где необходимо сохранить точные характеристики при высоких температурах. Ниобий и тантал, нанесенные на поверхность деталей, как губка, поглощают газы, обеспечивая стабильную работу приборов. С помощью этих металлов больших успехов достигла восстановительная хирургия. В медицинскую практику вошли не только пластинки из тантала, но и нити из тантала и ниобия. Хирурги успешно используют такие нити для сшивания порванных сухожилий, кровеносных сосудов и нервов. Танталовая «пряжа» служит для возмещения мускульной силы. С ее помощью хирурги укрепляют после операции стенки брюшной полости.
Рис. 4. Конструкция хвостового оперенья самолета из жаропрочной ниобиевой стали.
Тантал имеет исключительно прочную связь между атомами. Это обусловливает его чрезвычайно высокую температуру плавления и кипения. Механические качества и химическая стойкость приближают тантал к платине. Химическая промышленность использует такое благоприятное сочетание качеств тантала. Из него готовят детали кислотостойкого оборудования химических заводов, нагревательные и охладительные устройства, имеющие контакт с агрессивной средой.
В бурно развивающейся атомной энергетике находят применение два свойства ниобия. Ниобий обладает удивительной «прозрачностью» для тепловых нейтронов, т. е. способен пропускать их через слой металла, практически с нейтронами не реагируя. Искусственная радиоактивность ниобия (получающаяся при контакте с радиоактивными материалами) невелика. Поэтому из него можно делать контейнеры для хранения радиоактивных отходов и установки по их переработке. Другим не менее ценным (для ядерного реактора) свойством ниобия является отсутствие заметного взаимодействия с ураном и другими металлами даже при температуре 1000 °С. Расплавленные натрий и калий, применяемые в качестве теплоносителей в атомных реакторах некоторых типов, свободно могут циркулировать по ниобиевым трубам, не причиняя им никакого вреда.
|
|
|
Ниобий и тантал находят все больше и больше потребителей. Однако применение сдерживается трудностями их получения и, самое главное —высокой стоимостью очистки этих металлов. С удешевлением производства будет расширяться и сфера их использования.
Глава V. Нильсборий
Экспериментально установлено ранее неизвестное явление образования химического элемента с порядковым номером 105. Изотоп этого элемента с периодом полураспада Т1/2 ~ 2 с получен при облучении америция ядрами неона.
В статье «Рождение сто пятого», помещенной в газете «Известия» 13 августа 1970 г., приведено следующее высказывание академика Г. Н. Флерова:
«В сообщении Объединенного института ядерных исследований от 18 февраля 1970 года мы писали о синтезе спонтанно делящегося изотопа 105-го элемента...
Наша лаборатория хотела бы назвать этот элемент в честь выдающегося физика XX в. Нильса Бора. Это предложение мы уже направили в Международный союз чистой и прикладной химии».
Следуя прекрасной традиции, сложившейся среди ученых, сообщение о синтезе сто пятого элемента было разослано практически во все крупные лаборатории мира. Работы по синтезу этого элемента получили международное признание.
Данные, касающиеся синтеза нильсборня 105Ns, указывают на возможность получения сходным путем и более тяжелых элементов (например, 106) и позволяют довольно уверенно оценить их свойства.
Пожалуй, не менее ценное с точки зрения ядерной физики открытие состоит в том, что исследователями найден принципиально новый метод синтеза сверхтяжелых элементов. Если с 1943 по 1956 г., в результате цепных ядерных реакций при добавлении нейтронов к ядру определенного вида атомов, были получены элементы по сотый включительно, то в дальнейшем этот метод не дал результатов. Нейтрон не успевает слиться с ядром 100-го элемента, потому что это ядро делится быстрее, чем происходит реакция.
|
|
|
Новый путь основан на процессе взаимодействия ускоренных ионов с ядром тяжелого элемента. Так и были синтезированы курчатовий и нильсборий. Пучок ионов неона ускорялся на циклотроне и при интенснвности ~5.1012 в 1с сталкивался с мишенью, состоящей нз нескольких миллиграммов изотопа америция 243Аm. Происходил процесс слияния ядер мишени с налетающей частицей:
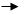
 243Am + 22Ne 265Ns* 265-x.n Ns + x.n
243Am + 22Ne 265Ns* 265-x.n Ns + x.n
После «испарения» нескольких нейтронов (4 и 5) из возбужденного составного ядра получается атом, имеющий в ядре 105 протонов, а общую массу 261 или 260. За сутки непрерывной работы циклотрона удается получить и обнаружить одно новое ядро. При облучении америция 243Am ионами неона 22Ne зарегистрирован спонтанно делящийся излучатель с периодом полураспада 1,8 ± 0,6 с.
Очень важен вопрос о химических свойствах 104-го и 105-го элементов. Согласно теоретическим представлениям, основанным на современном понимании периодической системы, 104-й и 105-й элементы должны резко отличаться от актиноидов и один от другого. Они должны быть химическими аналогами соответственно гафния и тантала, т. е. истинными экагафнием и экатанталом, как назвал бы их Дмитрий Иванович Менделеев.
 Рис. 7, Схема установки для экспрессного разделения и излучения короткоживущих радиоактивных изотопов:
Рис. 7, Схема установки для экспрессного разделения и излучения короткоживущих радиоактивных изотопов:
1 — поток газообразных носителей (температура Э50°С),
2 — мишень, на которую направляется пучок ускоренных ионов,
3—поток носителя с хлоридами элементом III, IV и V групп,
4—ловушка для твердых частиц хлоридов,
5— детекторы определения изотопов элементе» № 104, 105
Химической реакцией в газообразной фазе удалось доказать, что 104-й элемент действительно является аналогом гафния и проявляет валентность, равную четырем. Это первый тяжелый искусственный элемент, не входящий в семейство актиноидов. Следовательно, элементы 105-й, 106-й и т. д. будут находиться в V, VI и т.д. группах периодической системы.
Идентификация 105-го элемента была проведена тремя принципиально различными методами. Изучены основные типы распада ядер нового элемента, а также выяснено сходство его химических свойств с танталом. В частности, установлено сходство пентахлоридов и, вероятно, оксихлоридов тантала и нильсбория.
Литература:
1. Браун Т., Лемей Г.Ю., Химия в центре наук. М.: Мир. 1983.
2. Конареев Б.Н. Любознательным о химии. Неорганическая химия. М.: Химия. 1984.
|
|
|
3. Николаев Л.А. Нелрганическая химия. М.: Просвещение. 1982.
4. С.С. Олегин, Г.Н. Фадеев. Неорганическая химия. М.: Высшая школа. 1979.
5. Павлов Н.Н. Неорганическая химия. М.: Высшая школа. 1986.
6. Петров М.Н. Неорганическая химия. М.: Химия. 1981.
7. Популярная библиотека химических элементов – серебро, нильсборий и далее. М.: Наука. 1983.
8. Г.Н. Фадеев. Пятая вертикаль – элементы V группы переодической системы
Д.И. Менделеева. М.: Просвещение. 1985.
9. Ю.М. Шилов, М.И. Тарасенко, Ю.И. Слушкович, П.М. Чукуров. Общая химия. М.: Медицина. 1983.
|
|
|


