 |
Теория активных столкновений.
|
|
|
|
Основные положения теории:
1) столкновение реагирующих частиц,
2) наличие у этих частиц необходимой энергией – энергии активации,
3) оптимальное расположение частиц относительно друг друга – стерический фактор.
Энергия активации – минимальный избыток энергии, которой должны обладать реагирующие частицы (в расчете на моль), чтобы столкновения между ними приводили к химическому взаимодействию.
Энергию активации можно рассчитать по уравнению Аррениуса (1889)
 А – постоянная, определяемая опытным путем
Еа – энергия активации
А – постоянная, определяемая опытным путем
Еа – энергия активации
| е – основание натуральных логарифмов k – константа скорости реакции R – универсальная газовая постоянная T – абсолютная температура |
Неактивные молекулы могут быть превращены в активные при сообщении им дополнительной энергии – повышение температуры, лобовое столкновение, излучение (свет, радиация), электрический разряд, введение катализатора, в экзотермических реакциях – выделяющаяся теплота и т. д.).
Теория переходного состояния
Большинство химических процессов протекают через переходное состояние или образование активированного комплекса. Это более выгодный процесс, чем полный распад молекул исходных веществ, так как последние еще не распались, а уже начали формироваться молекулы продуктов реакции.
Для реакции: H2 + I2 = H2 · I2 = 2HI
| H2 + I2= | H ----------- I ½ ½ ½ ½ ½ ½ H ----------- I | = 2HI | |||
| исходные вещества | переходное состояние | продукты реакции | |||
| активированный комплекс |
Энергетический профиль реакции (Рис. 1).
A+B ® D+F
 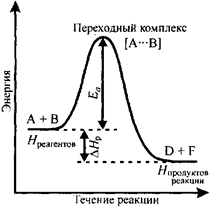
| Рис. 1 Энергетический профиль течения экзотермической реакции. Реакция происходит по схеме: А + В → [А···В] → D + F, Еа где [А···В] – переходное состояние. |
|
|
|
По оси ординат отложена энергия молекул, участвующих в реакции, а по оси абсцисс – путь реакции – последовательность промежуточных состояний, через которые проходит система в ходе элементарного акта от исходных веществ к продуктам реакции.
Для образования переходного состояния требуется затрата энергии.
Энергия активации – разность между энергией активированного комплекса и энергией молекул, вступающих в реакцию. Разность между энергией молекул, вступающих в реакцию, и продуктами реакции – тепловой эффект этого процесса – ΔНр.
Еа – энергия активации прямой реакции, Еа2 – обратной.
Катализатор и катализ.
Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе взаимодействия.
Катализаторы – вещества, изменяющие скорость реакции участием в образовании активированного комплекса или нескольких стадий химического превращения, но стехиометрически не являющиеся участниками суммарного процесса.
Катализ – явление, при котором происходит изменение скорости химической реакции под действием катализаторов (от греческого katalysis —разрушение).
Если катализатор увеличивает скорость реакции, катализ называют положительным, если же уменьшает — отрицательным. В последнем случае катализатор называют ингибитором.
Ингибитор вступает в химическое взаимодействие с реагентом, чаще с промежуточными веществами с образованием устойчивых соединений с низкой реакционной способностью
Пример. Для реакции разложения пероксида водорода катализатор – оксид марганца (IV), ингибитор – фосфорная кислота.
Реакции называются автокаталитическими (самоускоряющимися) при действии катализатора – одного из продуктов реакции. В этих случаях происходит изменение концентрации катализаторов. Пример. Растворение меди в азотной кислоте ускоряется образующимися оксидами азота.
|
|
|
С помощью катализатора можно изменить скорость термодинамически возможного процесса – ΔG<0. Поэтому термодинамически невозможную реакцию (∆G>0) катализатор вызвать не может.
В случае обратимой реакции положение химического равновесия катализатор не смещает, так как он в равной степени ускоряет (или замедляет) как прямую, так и обратную реакции и лишь изменяет время достижения химического равновесия.
Замечено, что примеси на катализатор влияют по-разному. Одни из них инертны, другие делают его более активным, а третьи ослабляют или совсем прекращают его действие, т. е. являются каталитическими ядами.
Вещества, которые сами по себе не обладают каталитической активностью, но, будучи добавленными, к катализатору, значительно повышают его действие, называют промоторами или активаторами. Например, если к оксиду ванадия (V) добавить небольшое количество сульфатов щелочных металлов, его каталитическая активность повышается в сотни раз при окислении оксида серы (IV) в оксид серы (VI).
|
|
|
12 |


