 |
Цель работы – провести обессоливание морской воды ионообменным методом и оценить эффективность процесса обессоливания по изменению электропроводности раствора морской воды.
|
|
|
|
Ход работы
Проба воды, подготовленная соответствующим образом (по мутности и окисляемости), в объеме 200-300 мл последовательно фильтруется через катионит в Н+ - форме и анионит в ОН- или HCO3- - форме. Скорость фильтрования устанавливается на уровне одна капля в секунду. Первые порции фильтрата (20-30) мл отбрасываются. После окончания фильтрования через анионит проводят определение солесодержания либо удельной электропроводности. Остаточное солесодержание при ступенчатом (одноступенчатом в данном случае) ионировании должно составить около 20 мг/л, что соответствует удельной электропроводности 35-45 мкОм-1·см-1. После окончания фильтрования проводят регенерацию ионообменников растворами соляной кислоты (5 %-ный раствор), щелочи или соды. Расход воды на промывку ионита принимают 10 м3/м3 ионита.
Удельная электропроводность растворов электролитов
Растворы кислот солей и оснований обладают способностью проводить электрический ток. Переносчиками тока в растворах электролитов являются катионы и анионы, которые образуются в результате их электролитической диссоциации. Подобно проводникам первого рода (металлам) растворы электролитов подчиняются закону Ома (уравнение 3):

| (3) |
| где ρ – удельное сопротивление, Ом·см; l – расстояние между электродами, см; s – площадь электрода, см2; R – сопротивление проводника, Ом. |
Удельная электропроводность рассчитывается по уравнению (4):
æ 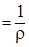 , ,
| (4) |
| где æ – удельная электропроводность, Ом-1·см-1; ρ – удельное сопротивление, Ом·см. |
Удельная электропроводность электролита является величиной обратной сопротивлению столба раствора длиной 1 см с площадью поперечного сечения в 1 см2. Измеряется удельная электропроводность в См/м или ом-1 см-1.
|
|
|
Специфическая особенность растворов электролитов состоит в том, что проводящая способность зависит от индивидуальных свойств ионов, от концентрации их общего числа в единице объема раствора, поэтому электропроводность определяется концентрацией растворов.
В связи с тем, что величина удельной электропроводности сильно зависит от концентрации, пользуются величиной удельной электропроводности, отнесенной к молярной концентрации эквивалента, обозначаемой λv. Отношение æ/с называют эквивалентной электропроводностью. Уравнения (5)-(7) связывают удельную и эквивалентную электропроводности:
| λv = V·æ; | (5) |
 ; ;
| (6) |
λv = 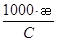 , ,
| (7) |
| где С – молярная концентрация эквивалента, моль/л; V – объем, cм3; λv – эквивалентная электропроводность, см2 ом-1 ·моль-1. |
Измерению электропроводности раствора предшествует определение константы ячейки (С٭), в которой проводятся измерения. Если бы расстояние между электродами в сосуде точно равнялось 1 см, а площадь каждого электрода равна 1 см2 и в проведении тока участвовал только объем раствора, заключенного между электродами, то измеренная в таких условиях электропроводность представляла бы истинную удельную электропроводность раствора.
В действительности электропроводность раствора зависит не только от размеров электродов и расстояния между ними, но и от их формы и взаимного расположения и объема раствора, поэтому удельная электропроводность не равна измеренной, а ей пропорциональна согласно уравнению (8):
| æист. = С*·æэ, | (8) |
| где æист. – истинная удельная электропроводность раствора, Ом-1·см-1; æэ – экспериментальная удельная электропроводность раствора, Ом-1·см-1; С* - константа ячейки. |
Порядок определения удельной электропроводности растворов и эффективности процесса обессоливания
|
|
|
1. Приготовить растворы хлорида калия из раствора хлорида калия с молярной концентрацией эквивалента 0,1 моль/л по таблице 2. Для разбавления растворов используются мерные колбы объемом 50 мл, за исключением концентраций 0,0005 моль/л, 0,001моль/л, – для них используются мерные колбы на 100 мл;
Таблица 2 – Эквивалентная электропроводность водных растворов KCl различных концентраций
| С, моль/л | 0,0005 | 0,001 | 0,005 | 0,01 | 0,02 | 0,03 | 0,10 |
| мл раствора KCl, 0,1 моль/л | 0,5 | 2,5 | |||||
| λ, ом-1·моль-1·см2 | 147,8 | 146,4 | 143,5 | 141,3 | 138,3 | 133,4 | 129,0 |
2. Для каждого приготовленного раствора измерить удельную электропроводность (æэ) на кондуктометре ОК – 102/1;
3. Вычислить истинную удельную электропроводность (æист.) для каждого раствора таблицы 2 по формуле (7);
4. Вычислить константу ячейки (C*) для каждой концентрации таблицы 2 по формуле (8);
5. Вычислить среднее арифметическое полученных значений констант ячейки ( );
);
6. Измерить на кондуктометре удельную электропроводность (æэ) морской воды до и после фильтрования на катионите и анионите;
7. Вычислить истинную удельную электропроводность (æист.) морской воды до и после фильтрования на катионите и анионите по формуле (9):
æист. = æэ·  , ,
| (9) |
где æист. – истинная удельная электропроводность раствора, Ом-1·см-1;
æэ – экспериментальная удельная электропроводность раствора, Ом-1·см-1;
 - константа ячейки. - константа ячейки.
|
8. Вычислить относительную электропроводность морской воды до и после фильтрования на катионите и анионите по формуле (10):
| R20 = æист/æ35‰, | (10) |
| где æ35‰ – электропроводность нормальной морской воды (49,895·10-3·ом-1·см-1). |
9. По значению относительной электропроводности R20, используя океанографические таблицы, определить соленость морской воды до и после фильтрования на катионите и анионите (S, ‰);
10. Рассчитать эффективность ионообменного метода обессоливания морской воды по формуле (11):

| (11) |
| где S1 – соленость морской воды до фильтрования на ионитах, ‰; S2 – соленость морской воды после фильтрования на ионитах, ‰. |
|
|
|


