 |
Двойной электрический слой. Электродный потенциал
|
|
|
|
При погружении металлической пластины в раствор соли данного металла (электрод или полуэлемент) может происходить один из двух процессов:
1. Если металл является активным восстановителем (т. е. легко теряет электроны), то под действием диполей воды, содержащихся в растворе, некоторая часть атомов металла оставляет свои электроны на электроде и в виде гидратированных ионов переходит в раствор:
Me0 + mH2О → Men+ • mН2О + п 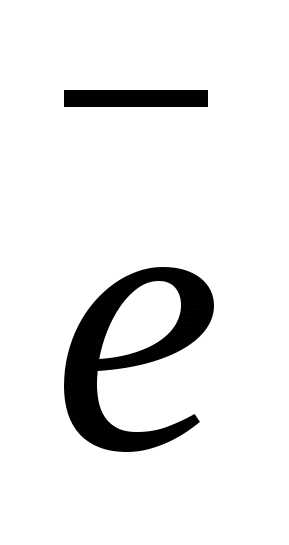 .
.
в растворе на электроде
Или без учета гидратации ионов:
Ме0→ Меn+ + п.
В результате этого процесса окисления металлическая пластинка заряжается отрицательно, а катионы металла притягиваются к ней и поэтому прилегающий к пластинке слой раствора заряжается положительно. Таким образом на границе металл—раствор возникает двойной электрический слой (ДЭС), как это показано на рис. 1.

23)
В электрохимии стандартный электродный потенциал, обозначаемый Eo, E0, или Eθ, является мерой индивидуального потенциала обратимого электрода (в равновесии) в стандартном состоянии, которое осуществляется в растворах при эффективной концентрации в 1 моль/кг и в газах при давлении в 1 атмосферу или 100 кПа (килопаскалей). Объёмы чаще всего взяты при 25 °C. Основой для электрохимической ячейки, такой, как гальваническая ячейка, всегда является окислительно-восстановительная реакция, которая может быть разбита на две полуреакции: окисление на аноде (потеря электрона) и восстановление на катоде (приобретение электрона). Электричество вырабатывается вследствие различия электростатического потенциала двух электродов. Эта разность потенциалов создаётся в результате различий индивидуальных потенциалов двух металлов электродов по отношению к электролиту.
|
|
|
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают ряд напряжений Николая Николаевича Бекетова (1827-1911), или ряд стандартных электродных потенциалов. Числовые значения стандартных электродных потенциалов для ряда технически важных металлов приведены в таблице.
Ряд напряжений металлов

Факторы, влияющие на величину ζ -потенциала:
1. Влияние индифферентных электролитов (не изменяющих φо-потенциал), не содержащих ионы, входящие в состав решетки твердой фазы:
А) в состав входят ионы, сходные с противоионами исходного ДЭС
↑Со =→ ↓δ (сжатие) =→ ↓ ζ -потенциал (кривая 1)
Влияние концентрации такого электролита на величину z- потенциала иллюстрирует рис.5.4.
2 Влияние неиндифферентных электролитов (способных изменять φо-потенциал), содержащих ионы, которые могут входить в состав решетки твердого тела):
А) ион, способный входить в состав решетки твердого тела имеет тот же знак, что и φо-потенциал
.
 Рис.5.7. Зависимость электрокинетического потенциала от концентрации неиндифферентных ионов
Рис.5.7. Зависимость электрокинетического потенциала от концентрации неиндифферентных ионов
Например, потенциалопределяющими ионами мицеллы {m[AgJ]nAg+(n-x)NO3-}+xNO3-служат неиндифферентные ионы Ag+, и мы добавляем в систему раствор-электролитAgNO3.
При малых концентрациях электролита с увеличением концентрации С электрокинетический потенциал растет за счёт повышения потенциала поверхности j0при адсорбции на ней неиндифферентных ионов.
При повышенных концентрациях электролита преобладающим становится влияние ионов NO3-, введенных вместе с неиндифферентными - противоионами ДЭС. Они сжимают диффузный слой, вызывая снижениеz- потенциала. По этой причине в данном случае зависимость электрокинетического потенциала мицелл от концентрации неиндифферентных ионов имеет экстремум (рис. 5.7).
Б) Влияние электролита, содержащего неиндифферентные ионы противоположные по знаку потенциалопределяющим ионам мицеллы.
|
|
|
Например, к системе мицелл {m[AgJ]nAg+(n-x)NO3-}+хxNO3-прибавляют электролит KJ, содержащий неиндифферентные ионы J-, противоположные по знаку потенциалопределяющим ионам Ag+.
В этом случае адсорбция ионов йода на поверхности агрегата приведёт к снижению j0потенциала поверхности и тем самым – к снижению иz- потенциала. Это видно из рис. 5.8. На нём увеличение концентрации электролита от С1до С3приводит к снижениюj0потенциала отj01доj03, аz-потенциала – отz1 доz3.
В предельном случае при С4возможна перезарядка коллоидной частицы -z4 приj04.
24)
|
|
|


