 |
Тестовые задания. Выберите один правильный ответ. Окислительно-восстановительные реакции. Оксидиметрия. Окислитель + е ↔ сопряженный восстановитель
|
|
|
|
Тестовые задания
Выберите один правильный ответ
1. pH (дождевой воды) = 6. Концентрация ионов [OH-] в воде, моль/л, равна:
1) 10-6 2) 10-8 3) 6 4) 8
2. Сильной кислотой является:
1) H3PО4 2) HNO2 3) HBr 4) HF
3. Не является сильным электролитом:
1) Ca(OH)2 3) NH3
2) H2SO4 4) NaNO3
4. Щелочная среда образуется в растворе соли:
1) KCl 3) Al2S3
2) Na2CO3 4) CuSO4
5. Гидролиз протекает по катиону в растворе соли:
1) Na2SiO3 3) FeCl3
2) K3PO4 4) CaBr2
6. Объем 0, 22N H3PO4, который пойдет на титрование 85, 0 мл 0, 185N Ba(OH)2:
1) 85. 0мл 3) 170, 0мл
2) 71, 5мл 4) 47, 7мл
7. На титрование 10 мл 0, 1N раствора щавелевой кислоты израсходовано 20 мл
раствора KOH. Нормальность раствора гидроксида калия::
1) 0, 1 3) 0, 25
2) 0, 05N 4) 0, 01
8. Раствор димедрола титруют раствором NaOH.
Предположите, какой индикатор можно выбрать и почему?
1) фенолфталеин, потому что pH т. экв. > 7
2) метиловый оранжевый, т. к. pH т. экв. < 7
3) фенолфталеин, потому что pH т. экв < 7
4) метиловый оранжевый, т. к. pH т. экв. > 7
9. Раствор кофеина титруют HClO4 .
|
|
|
Предположите, какой индикатор можно выбрать и почему?
1) фенолфталеин, потому что pH т. экв. > 7
2) метиловый оранжевый, т. к. pH т. экв. < 7
3) фенолфталеин, потому что pH т. экв < 7
4) метиловый оранжевый, т. к. pH т. экв. > 7
10. Показатель pH 0. 005 М раствора серной кислоты равен:
1) 5 2) 2 3) 3 4) 10-5
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОКСИДИМЕТРИЯ
Оксидиметрия – это один из методом количественного (титриметрического) анализа, в основе которого лежат окислительно-восстановительные реакции (ОВР).
ОВР – химические реакции, протекающие с изменением степени окисления атомов вследствие перераспределения электронов между ними.
Окислением называется процесс отдачи электронов.
Восстановлением называется процесс присоединения электронов.
Окислителем называется вещество, в состав которого входят атомы, присоединяющие электроны, т. е. окислитель – акцептор электронов.
окислитель + е ↔ сопряженный восстановитель
Восстановителем называется вещество, в состав которого входят атомы, отдающие электроны, т. е. восстановитель – донор электронов.
восстановитель – е ↔ сопряженный окислитель
Взаимодействие веществ в окислительно-восстановительных реакциях подчиняется закону эквивалентов:
СN(OX)VOX = СN(RED)VRED или nэкв(ox) = nэкв(red),
где СN – нормальная концентрация (моль× экв/л), V – объем (мл или л), nэкв – количество моль эквивалентов (моль× экв).
Эквивалентом окислителя или восстановителя называется его частица (реальная или условная), которая присоединяет или отдает один электрон.
Моль эквивалент – количество вещества, эквивалентное в окислительно-восстановительных реакциях 1 моль электронов.
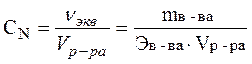 ,
,
или СN = СМ × z,
где Э – молярная масса эквивалента или эквивалентная масса, которая рассчитывается по формуле: Э = М/z, z – число передаваемых электронов.
|
|
|
Следует различать окислительно-восстановительные эквиваленты веществ от их эквивалентов в реакциях обмена /не сопровождающихся переходом электронов. Так, в реакции 6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 +K2SO4 + 7H2O, эквивалент окислителя ЭK2Cr2O7 = 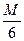 .
.
В то же время в реакции K2Cr2O7 + 2КОН = 2 K2Cr2O4 + Н2О эквивалент K2Cr2O7 = 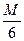 .
.
Классификация окислительно-восстановительных реакций
а) Межмолекулярное окисление-восстановление. В этом случае окислитель и восстановитель входят в состав двух разных молекул:
2 Al + 6HCl = 2 AlCl3 + 3H2,
2FeCl3 + SnCl2 = 22FeCl2 + SnCl4.
б) Внутримолекулярное окисление-восстановление – когда окислитель и восстановитель входят в состав одного сложного вещества, но представлены разными атомами:
(NH4)2 Cr2O7 = N2 + 4H2O + Cr2O3.
в) Аутоокислительные реакции /реакции диспропорционирования/. Окислителями и восстановителями служат одинаковые атомы или ионы, окисляющие и восстанавливающие друг друга:
Cl2 + H2O =HClO + HCl.
|
|
|


