 |
Пример 2. 2) Запишем ионную схему реакции: CrO2- + H2O2 → CrO42- + H2O. 3) Составим частные электронно-ионные уравнения /полуреакции/:
|
|
|
|
Пример 2.
Закончите уравнение реакции, подберите коэффициенты методом электронно-ионного баланса, и рассчитайте эквивалентую массу окислителя: NaCrO2 + NaOH + H2O2 → ….
Решение:
1) Допишем продукты реакции: NaCrO2 + NaOH + H2O2 → Na2CrO4 + H2O.
2) Запишем ионную схему реакции: CrO2- + H2O2 → CrO42- + H2O.
3) Составим частные электронно-ионные уравнения /полуреакции/:
Для процесса окисления хромата натрия:
а/ CrO2- → CrO4-;
б/ CrO2- + 4OH → CrO2-4 + 2H2O, /подведение баланса вещества/
в/ CrO2- + 4OH- - 3е → CrO2-4 + 2H2O. /соблюдение равенства зарядов/
Для процесса восстановления пероксида водорода:
Н2О2 + 2е → 2ОН-.
4) Подведем баланс зарядов и выведем коэффициенты:
CrО-2 + 4OH- - 3е → CrO42- + 2H2O, окисление │ 2;
H2O2 + 2е → ОН-, восстановление │ 3.
5) Суммируем частные уравнения реакций окисления и восстановления после умножения на соответствующие коэффициенты:
2CrО-2 + 2OH- + 3Н2О2 → 2 CrO42- + 4 H2O.
6) Приведение подобных членов и сокращение:
2CrО-2 + 2OH- + 3Н2О2 → 2CrO42- + 4H2O.
(в данном случае сокращение не требуется)
7) Записываем уравнение реакции в молекулярном виде с учетом полученных коэффициентов:
2NaCrO2 + 2NaOH + 3H2O2 = 2Na2CrO4 + 4H2O
8) Проверяем баланс по элементам в молекулярном уравнении. В данном случае никаких уточнений не требуется.
9) Рассчитаем молярную массу эквивалента окислителя, в данном случае пероксида водорода:
Э = М/z, где М – молярная масса Н2О2, равная 34 г/моль, z – число переносимых электронов.
Э(Н2О2) = 34/2 = 17 г/моль∙ экв.
Пример 3.
Напишите уравнения реакций между перманганатом калия и сульфитом калия в кислой, щелочной и нейтральной средах. Уравняйте методом электронно-ионного баланса.
|
|
|
Решение:
а) Кислая среда
KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
MnO4- + SO32- + H+ → Mn2+ + SO42- + H2O
MnO4- + 8H+ + 5е → Mn2+ + 4H2O, восстановление | 2
SO32- + H2O – 2е → SO42- + 2H+ , окисление | 5
2MnO4- + 16 H+ + 5SO32- + 5H2O → 2Mn2+ +5SO42- + 8H2O +10H+
2MnO4- + 6 H+ + 5SO32- → 2Mn2+ +5SO42- + 3H2O
2MnO4 + 5K2 SO3 + 3H2SO4 + 2MnSO4 + 6K2SO4 + 3H2O.
б) Щелочная среда
KMnO4 + K2SO3 + KOH → KMnO4 + K2SO3 + H2O
MnO4- + SO32 + OH- → MnO4- + SO42 + H2O
MnO4- + е → MnO42-, восстановление | 2
SO32- + 2OH- - 2е → SO42- + H2O, окисление | 1
2MnO4- + SO32 + 2OH- → 2MnO4- + SO42 + H2O
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O.
в) Нейтральная среда
KMnO4 + K2SO3 + H2O → MnO2 + К2SO4 + КOН
MnO4- + SO32- + H2O → MnO2 + SO42- + OH-
MnO4- + 2H2O + 3е → MnO2 + 4OH-, восстановление | 2
SO32- + 2OH- - 2е → SO42- + 2H2O, окисление | 3
2MnO4- + 4H2O + 3SO32- → 2MnO2 + 8H2O- + 3SO42- + 2H2O
2MnO4- + 3SO32- + H2O → 2MnO2 + 3SO42- + 2OH-
2KMnO4 + 3K2SO3 + H2O → 2MnO2 +3К2SO4 + 2КOН
Пример 4.
В каком направлении в стандартных условиях будет протекать реакция: КСl + Br2 = KBr + Cl2? j (Br20/2Br-) = +1, 09В, j (Cl20/2Cl-) = +1, 36В.
Решение: Для определения направления реакции рассчитаем ее ЭДС. Для этого определим, что является окислителем, а что является восстановителем:
КСl-1 + Br20 = KBr-1 + Cl20; Сl-1 – отдает свои электроны, следовательно, является восстановителем, Br2 – окислителем.
ЭДС рассчитываем по формуле: ∆ E0 = j0ок-ля – j0вос-ля = 1, 36 – 1, 09 = 0, 28 > 0. Т. к. ЭДС реакции больше нуля, то она протекает самопроизвольно в прямом направлении.
Ответ: реакция протекает самопроизвольно в прямом направлении.
Пример 5.
Рассчитайте молярную концентрацию нитрита натрия, если на титрование 20 мл его раствора, пошло 12, 5 мл 0, 01 М раствора дихромата калия в кислой среде.
Решение: Для определения концентрации нитрита натрия воспользуемся законом эквивалентов: nэкв(ox) = nэкв(red) или СN(OX)VOX = СN(RED)VRED.
Для расчета нормальной концентрации дихромата калия запишем уравнение протекающей реакции и уравнения полуреакций:
NaN+3O2 + K2Cr+62O7 + H2SO4 ® Cr+32(SO4)3 + NaN+5O3 + H2O + K2SO4;
|
|
|
N+3 – 2e ® N+5
2Cr+6 + 6e ® 2Cr+3
Рассчитаем нормальную концентрацию K2Cr2O7:
СN = СМ × z,
где z – число переносимых электронов.
СN(K2Cr2O7) = 0, 01× 6 = 0, 06 моль× экв/л.
Найдем концентрацию нитрата натрия по закону эквивалентов:
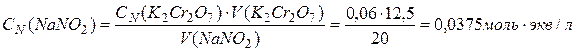 .
.
Перейдем к молярной концентрации нитрата натрия по формуле:
СМ = СN / z = 0, 0375/2 = 0, 01875 моль/л.
Ответ: 0, 01875 моль/л.
Задачи для самостоятельного решения
1. Закончите уравнения реакций (где это необходимо), подберите коэффициенты методом электронного баланса. Рассчитайте эквивалентную массу окислителя.
а) Cr2(SO4)3 + KClO3 + NaOH = KCl + …
б) Cu2S + O2 + CaCO3 = CuO + CaSO3 + CO2
в) Zn + H2SO4(конц) = H2S + …
г) FeS + O2 = Fe2O3 + …
д) NaMnO4 + HI = I2 + NaI +...
е) NaMnO4 + KNO2 + H2SO4 = …
ж) KMnO4 + S = K2SO4 + MnO2
з) Cr(OH)3 + Ag2O + NaOH → Ag + …
и) Cr(OH)3 + Br2 + NaOH → NaBr + …
к) NH3 + KMnO4 + KOH → KNO3 + …
2. Закончить уравнение ОВР, подобрать коэффициенты электронно-ионным методом, рассчитать молярные массы эквивалентов окислителя и восстановителя в реакции:
а) K2Cr2O7+H2S+H2SO4 → Cr2(SO4)+S+…
б) Na3AsO3+KMnO4+KOH→ Na3AsO4+K2MnO4+ …
в) NaNO2+KJ+H2SO4→ J2+NO+…
г) KMnO4+H2O2+H2SO4→ MnSO4+…
д)H2O2+KJO3+H2SO4→ J2+O2+…
е) Cr2(SO4)3 + KClO3 + NaOH → Na2CrO4 + KCl + …
ж) FeCl2 + HClO4 + HCl → Cl2 + …
з) NaNO2+K2Cr2O7 +H2SO4 → NaNO3 + …
и) KMnO4 + MnSO4 + H2O → H2SO4 + …
к) KMnO4 +HCl → Cl2 + …
л) KMnO4 + H2SO4 + H2C2O4 → CO2 + …
м) H2O2 + CrCl3 + KOH → K2CrO4 + H2O + …
3. Рассчитайте ЭДС процесса и определите, в каком направлении данная ОВР протекает самопроизвольно:
Н2SO4+2HCl ↔ Cl2+H2SO3+H2O?
(φ o(Cl2 /2Cl― )=+1, 36В, φ º (SO42― /SO32― ) = +0, 22 В)
4. В каком направлении данная ОВР протекает самопроизвольно:
CuSO4 + Zn ↔ ZnSO4 + Cu?
(φ o(Zn2+/Zn)= -0, 76В, φ º (Cu2+/Cu) = +0, 34 В)
5. В каком направлении данная ОВР протекает самопроизвольно:
2NaCl+Fe2(SO4)3↔ 2FeSO4+Cl2+Na2SO4
φ º (Cl2/2Cl–)=+1, 36В, φ º (Fe3+/Fe2+)=+0, 77В.
6. В каком направлении данная ОВР протекает самопроизвольно:
2KMnO4 + 5SnSO4 + 8H2SO4 ↔ 2MnSO4 + 5Sn(SO4)2 + K2SO4 + 8H2O?
φ º (MnO4-/Mn2+)=+1, 51В, φ º (Sn4+/Sn2+)=+0, 15В. Ответ обоснуйте.
7. Допустимо ли одновременное введение внутрь больному FeSO4 и NaNO2, учитывая, что среда в желудке кислая?
φ º Fe3+/Fe2+=+0, 77В, φ º NO2─ /NO=+0, 99В. Ответ обоснуйте.
8. Определите окислительно-восстановительные свойства Н2О2, которые он проявляет при взаимодействии с K2Cr2O7 в кислой среде. φ º (О2/Н2О2)=+0, 68В, φ º (Cr2O72–/2Cr3+)=+1, 33В. Ответ обоснуйте.
9. Какие галогены окисляют Fe2+ до Fe3+? Какие из галогенид-ионов могут восстановить Fe3+? Напишите уравнения соответствующих реакций. Рассчитайте ЭДС каждой из реакций и определите знак DG. При расчете используйте следующие значения окислительно-восстановительных потенциалов:
|
|
|
φ º Fe3+/Fe2+=+0, 77В;
φ º (F2/2F–)=+2, 87В;
φ º (Cl2/2Cl–)=+1, 36В;
φ º (Br2/2Br–)=+1, 07В;
φ º (I2/2I–)=+0, 54В.
10. Сколько граммов KMnO4 необходимо взять, чтобы приготовить 100 мл 0, 04 N раствора для титрования его в кислой среде?
11. Рассчитать (приблизительно) нормальность 20% раствора KMnO4 в щелочной среде. (ρ =1г/мл).
12. Титр Н2С2О4· 2Н2О равен 0, 0069г/мл. На титрование 30мл этого раствора расходуется 25мл раствора КМnO4. Рассчитайте нормальность этого раствора.
13. В 1 литре раствора железного купороса содержится 16 г (FeSO4· 7H2O). Какой объем этого раствора может быть окислен 25мл 0, 1н раствора КMnO4 в кислой среде?
14. Молярная концентрация окислителя в растворе равна 0, 02моль/л. Определите нормальную концентрацию окислителя, принимая во внимание химизм реакции.
KMnO4+H2O2+H2SO4→ MnSO4+…
15. Молярная концентрация восстановителя в растворе равна 0, 05 моль/л. Определить нормальную концентрацию восстановителя, принимая во внимание химизм реакции:
H2O2+KJO3+H2SO4→ J2+O2+…
|
|
|


