 |
Тестовые задания. Выберите один правильный ответ. Химическая кинетика. Химическое равновесие. Влияние природы реагирующих веществ
|
|
|
|
Тестовые задания
Выберите один правильный ответ
1. Нормальным условиям соответствуют следующие значения параметров состояния:
1) р = 1 атм, Т = 298 К. 3) р = 1 атм, Т = 273 К.
2) р = 0 атм, Т = 0°С. 4) р = 1 атм, Т = 20°С.
2. Какой параметр поддерживается постоянным в изотермических условиях?
1) Т. 2) р. 3) V. 4) Q.
3. Какую систему представляет собой живой организм?
1) изолированную 3) закрытую
2) открытую 4) адиабатическую
4. При экзергонических процессах происходит:
1) увеличение энтропии 3) увеличение энергии Гиббса
2) уменьшение энтропии 4) уменьшение энергии Гиббса
5. Согласно первому закону термодинамики, подводимая к системе теплота расходуется:
1) на совершение работы
2) на изменение внутренней энергии системы
3) на изменение внутренней энергии системы и совершение работы
4) теплота не расходуется, а поглощается системой
6. Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы
2) зависят от пути процесса
3) зависят от начального состояния системы
4) зависят только от конечного состояния системы
7. Как изменяется энтропия и энергия Гиббса системы при самопроизвольном растворении твердого вещества в воде?
1) Δ S > 0; Δ G > 0. 3) Δ S > 0; Δ G < 0.
2) Δ S < 0; Δ G > 0. 4) Δ S < 0; Δ G < 0.
8. Для какого вещества стандартная теплота образования равна нулю?
| 1) CO2. 2)C2H5OH. | 3) AgCl. 4) S. |
9. Стандартная теплота сгорания какого из веществ равна нулю?
1) Cl2O3. 2) Cl2O. 3) Cl2O7. 4) Cl2O5.
|
|
|
10. Энтальпии образования CaCO3 соответствует тепловой эффект реакции:
1) CaO + CO2 = CaCO3.
2) Ca + C + 3/2O2 = CaCO3.
3) CaO + CO + 1/2O2 = CaCO3.
4) Ca(OH)2 + H2CO3 = CaCO3 + 2H2O.
11. В результате реакции, термохимическое уравнение которой: СО2 + 2NH3 = (NH2)2CO + H2O + 336 кДж, выделилось 168 кДж теплоты. Количество аммиака равно моль.
1) 0, 5. 2) 1. 3) 2. 4) 4.
12. Процессы, протекающие при постоянном объеме, называются:
1) изотермическими 3) изохорными
2) изобарными 4) адиабатическими
13. В изобарно-изотермическом процессе роль т/д потенциала выполняет:
1) DG. 2) DA. 3) DS. 4) DU.
14. Определите направление реакции 2СО2 = 2СО + О2 при 298 К, если для этой реакции: Δ S0 = 247 Дж/моль·К и Δ Н0 = -565, 98 кДж/моль.
1) прямое 3) равновесие
2) обратное 4) из имеющихся данных определить невозможно
15. В каком случае величина внутренней системы будет наибольшей:
1) 1 моль жидкой воды.
2) 1 моль льда.
3) 1 моль водяного пара при 180° С.
4) 0, 5 моль водяного пара при 180° С
16. Энтальпии образования NaCl соответствует тепловой эффект реакции:
1) Na + 2HCl = NaCl + H2. 3) NaOH + HCl = NaCl + H2O.
2) 2Na + Cl2 = 2NaCl. 4) Na + 1/2Cl2 = NaCl.
17. В результате реакции, термохимическое уравнение которой: С2Н5ОН + ½ О2 = СН3СНО + 256 кДж, выделилось 128 кДж теплоты. Масса уксусного альдегида равна:
1) 45г. 2) 90г. 3) 11, 25г. 4) 22, 5г.
18. Какой закон лежит в основе расчета калорийности продуктов питания:
1) Гесса. 3) Вант-Гоффа.
2) Рауля. 4) Менделеева-Клайперона.
19. В каком соотношении находятся энтропии трех агрегатных состояний одного вещества: газа, жидкости, твердого тела:
1) S(г) > S (ж) > S (тв). 3) S(тв) > S (ж) > S (г).
|
|
|
2) S(ж) > S (г) > S (тв).. 4) Агрегатное состояние не влияет на значение
энтропии.
20. Определите изменение стандартной энергии Гиббса и направление реакции 4NH3 + 3O2 = 6H2O + 2N2, если стандартные энергии Гиббса образования веществ равны: Δ G0(NH3) = -16, 7 кДж/моль, Δ G0(Н2О) = -228, 6 кДж/моль.
1) 1304, 8 кДж/моль, обратное. 3) -1304, 8 кДж/моль, обратное.
2) -1304, 8 кДж/моль, прямое. 4) -211, 9 кДж/моль, прямое.
ХИМИЧЕСКАЯ КИНЕТИКА. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическая кинетика — раздел химии, изучающий механизмы химических реакций и скорости их протекания.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (в случае гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенной реакции).
Скорость химической реакции зависит от природы и состояния реагирующих веществ, концентрации, температуры реакции, поверхности соприкосновения для гетерогенных систем, катализатора, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ).
Влияние природы реагирующих веществ
Природа реагирующих веществ – это не только их состав, но и вид частиц, которые непосредственно участвуют в реакции: атомы, молекулы, ионы или радикалы. Реакции между молекулами протекают обычно медленно, а между ионами и радикалами – быстро.
Влияние концентрации реагентов.
Зависимость скорости реакций от концентрации реагирующих веществ описывается основным закоом химической кинетики , устанавливающий: скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению А + В = С + Д, этот закон выразится уравнением:
V = k · CA ∙ CB, (1)
где СА и СВ – молярные концентрации вещества А и В; k – константа скорости реакции. Физический смысл константы скорости - она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1моль/л или когда их произведение равно единице.
|
|
|
Основной закон химической кинетики часто называют законом действующих масс.
Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора, но не зависит от концентрации вещества.
Уравнение (1), связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Для реакции, записанной в общем виде 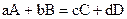 , кинетическим уравнением будет
, кинетическим уравнением будет
V = k · CmA ∙ CnB, (2)
где m и n – показатели степени, которые устанавливаются опытным путем и в большинстве случаев не равны стехиометрическим коэффициентам а и b в уравнении реакции.
Уравнение (2) является общим алгебраическим выражением закона действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам соответствующих веществ в уравнении реакции.
Сумма m + n называется порядком реакции и, как правило, имеет значение от 0 до 3 (не исключены и дробные значения и даже отрицательные).
Порядок реакции – формально-кинетическая характеристика процесса, не отражает механизма реакции, лишь характеризует зависимость скорости от концентрации.
Основной закон химической кинетики не учитывает концентрации реагирующих веществ в твердом состоянии, ибо их концентрации постоянны и они реагируют лишь на поверхности, которая остается неизменной.
Молекулярность реакции – это молекулярно-кинетическая характеристика процесса, отражающая его механизм. Определяется числом частиц, одновременно взаимодействующих в элементарном акте.
В зависимости от количества молекул, принимающих участие в элементарном акте реакции, различают моно-, би- и тримолекулярные реакции.
Лишь для одностадийных (элементарных) реакций порядок совпадает с молекулярностью. Для простых реакций стехиометрическое уравнение отражает истинный механизм.
|
|
|
|
|
|


