 |
Методика расчета термодинамических характеристик
|
|
|
|
Теплота сгорания вещества (Q) – тепловой эффект реакции окисления кислородом элементов, входящих в состав этого вещества до образования высших оксидов (CO2(г), H2O(ж)). Теплоту сгорания обычно относят к стандартному состоянию (р=101,3 кПа; Т=298 К), одному молю топлива и называют стандартной теплотой сгорания  (кДж/моль).
(кДж/моль).
Для углеводородов продуктами сгорания являются СО2 (газ) и Н2О(ж). Азот, входящий в состав сжигаемого соединения, превращается в N2; галогены – в HCl, HBr, HJ; сера – в SO2.
Сгорание топлива – быстрая реакция взаимодействия углеводородов и примесей топлива с кислородом воздуха. При сгорании происходит превращение химической энергии топлива в тепловую и далее в механическую.
При сгорании топлива выделяется тепло, количество которого зависит от состава горючей смеси и свойств самого топлива.
Способность топлива выделять при полном сгорании то или иное количество тепла обусловливается его теплотой сгорания (теплотворной способностью).
Различают высшую и низшую теплоту сгорания. Если вода, содержащаяся в топливе и образующаяся при сгорании водорода топлива, присутствует в виде жидкости, то количество выделившейся теплоты характеризуется высшей теплотой сгорания, если – в виде пара, то теплота сгорания называется низшей.
Высшая теплота сгорания топлива – количество теплоты, которое выделяется при полном сгорании топлива, включая теплоту конденсации водяных паров при охлаждении продуктов сгорания.
Низшая теплота сгорания топлива – количество теплоты, которое выделяется при полном сгорании топлива, но без учета теплоты конденсации водяного пара.
В двигателях внутреннего сгорания температура выходящих газов выше температуры конденсации водяных паров, поэтому при расчетах пользуются значениемнизшей теплоты сгорания.
|
|
|
Реакция сгорания может быть выражена следующим уравнением:
С n Н m O r + 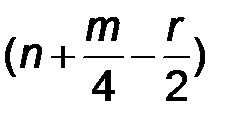 ×(O2 + 3,75 N2)
×(O2 + 3,75 N2) 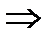
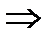 n CO2(г) +
n CO2(г) + 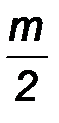 H2O(ж) +
H2O(ж) +  ×3,75 N2, (1)
×3,75 N2, (1)
где n, m, r – число атомов углерода, водорода и кислорода, соответственно, в соединении (топливо); (О + 3,75N2) – состав воздуха, моль.
Расчет теплоты сгорания, как любого теплового эффекта, проводится с использованием закона Гесса [1, 2].
Высшая энтальпия сгорания топлива рассчитывается в соответствии с уравнением реакции (1), 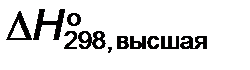 (кДж/моль топлива):
(кДж/моль топлива):
 ,
,
где  – стандартная энтальпия сгорания исходных органических веществ, кДж/моль;
– стандартная энтальпия сгорания исходных органических веществ, кДж/моль;  – стандартная энтальпия сгорания конечных продуктов, кДж/моль.
– стандартная энтальпия сгорания конечных продуктов, кДж/моль.
Энтальпии сгорания H2O(ж), CO2(г) и N2(г) принимаются равными нулю, так как они являются конечными продуктами сгорания.
Тогда высшая энтальпия сгорания может быть рассчитана по уравнению:
 .
.
Высшая теплота сгорания топлива (теплотворная способность топлива) QВ (кДж/кг, МДж/кг топлива) рассчитывается по уравнению:
QВ 
где М – масса моля топлива, г/моль.
Для сравнения различных топлив по теплотворной способности в качестве базы принята единица условного топлива (у.т.), имеющего теплоту сгорания, равную 29,3 МДж/кг твердого и жидкого топлива и 29,3 МДж/м3 газообразного топлива.
Низшая энтальпия сгорания топлива 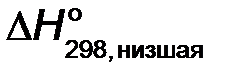 (кДж/моль топлива) рассчитывается по уравнению реакции (2):
(кДж/моль топлива) рассчитывается по уравнению реакции (2):
С n Н m O r + 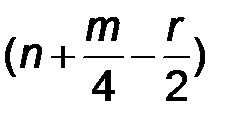 ×(O2+3,75 N2)
×(O2+3,75 N2) 
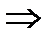 n CO2(г) +
n CO2(г) + 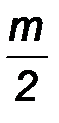 H2O(г)+
H2O(г)+  ×3,75 N2, (2)
×3,75 N2, (2)
 .
.
Низшая энтальпия сгорания топлива отличается от высшей на энтальпию конденсации водяного пара (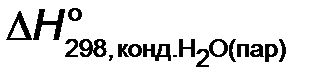 =−44,01 кДж/моль). Поэтому
=−44,01 кДж/моль). Поэтому
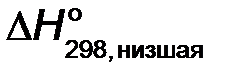

 .
.
Низшая теплота сгорания топлива QН (кДж/ кг, МДж/кг топлива)
QH 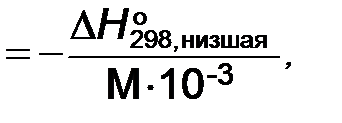
где М − масса моля топлива, г/моль.
Для полного сгорания массовой или объемной единицы топлива необходимо вполне определенное количество воздуха, которое называется теоретически необходимым.
Теоретически необходимое количество воздуха для полного сгорания 1 кг топлива (кг воздуха / кг топлива) для реакции (1) рассчитывается по уравнению:
|
|
|
 ,
,
где М 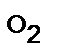 , М
, М  , М топлива – масса моля кислорода, азота и топлива, соответственно, г/моль.
, М топлива – масса моля кислорода, азота и топлива, соответственно, г/моль.
От соотношение топлива и воздуха зависит соотношение между СО2 и СО в продуктах горения.
В реальных условиях воздух для сгорания подается с некоторым избытком. Подвод большего количества воздуха по сравнению с теоретически необходимым обусловливается тем, что на практике не достигается полного и достаточно быстрого перемешивания поступающего воздуха с топливом, из-за чего температура топливовоздушной смеси может упасть ниже температуры воспламенения топлива, при этом часть его не успевает сгореть. Если подача воздуха недостаточна, то топливо сгорает не полностью, в продуктах горения увеличивается доля СО. Поэтому необходимо соблюдать оптимальное соотношение между топливом и воздухом.
Количество топливовоздушной смеси (М1, моль) для реакции (1) равно:
М1 = 1топлива +  ×(О2 + 3,75N2).
×(О2 + 3,75N2).
Низшая теплота сгорания топливовоздушной смеси (калорийность стехиометрической смеси топлива с воздухом, q н, кДж/м3) рассчитывается как отношение теплоты сгорания единицы топлива к общему количеству горючей смеси:

где 22,4·10-3 м3 /моль – объем моля топлива при нормальных условиях.
Полученные результаты представляют в виде таблицы, в которой сравниваются характеристики традиционного вида топлива (бензина) и вещества, предлагаемого в качестве альтернативного топлива (табл. 4).
Таблица 4
Сравнительные характеристики (Qн,  , qн) данного
, qн) данного
|
|
|


