 |
Классификация кислот (работа с приложением 1)
|
|
|
|
Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами – эти свойства являются общими для неорганических и органических кислот.
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков
Растворы кислот изменяют цвет индикаторов: лакмуса – в красный, метилового оранжевого – в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. Рассматривая это свойство неорганических и органических кислот, подчеркнем, что взаимодействие HNO3 и Н2SO4(конц.) с металлами (приложение 2) протекает иначе, но эти особенности указанных кислот будут объяснены несколько позднее.
 3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
 4. И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации):
4. И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации):
5. Реакция между кислотами и солями идет только в том случае, если образуется газ или осадок:
Взаимодействие фосфорной кислоты Н2РO4 с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка фосфата кальция Са3(РO4)2.
6. Сложные эфиры образуют не только органические кислоты согласно общему уравнению:
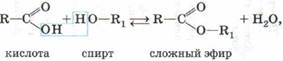
но и неорганические кислоты, например азотная и серная:

Вместе с тем отдельные представители минеральных и органических кислот имеют и особые свойства.
|
|
|
Особенности свойств азотной HNO3 и концентрированной серной Н2SO4(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы Н+, а нитрат- и сульфат-ионы.
 Муравьиная кислота НСООН, в отличие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией – альдегидокислотой и, в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала»:
Муравьиная кислота НСООН, в отличие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией – альдегидокислотой и, в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала»:
Образующаяся угольная кислота Н2СO3 распадается на воду и углекислый газ, который в избытке аммиака превращается в гидрокарбонат аммония.
Основания органические и неорганические.
На каждом этапе развития ваших химических знаний основания, как и кислоты, вы определяли по-разному.
| Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими гидроксогруппами (в зависимости от степени окисления металла). |
С точки зрения теории электролитической диссоциации
| Основания – это электролиты, которые при диссоциации образуют в качестве отрицательных ионов только гидроксид-анионы. |
Наконец, в свете протолитической теории Брёнстеда-Лоури
| Основания – это молекулы или ионы, которые служат акцепторами катионов водорода Н+ (протонов). |
Последнее определение более полное, так как оно позволяет включить в класс оснований фторид-ион, аммиак, амины и другие вещества, которые оказались бы за рамками этого класса, если опираться на первое и второе определения. Классификация оснований по различным признакам дана в приложении 3.
Химические свойства оснований
Свойства щелочей
1. Водные растворы щелочей мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов: лакмуса – в синюю, фенолфталеина – в малиновую.
|
|
|
2. Водные растворы оснований (растворимых) диссоциируют.
3. Взаимодействуют с кислотами, вступая с ними в реакцию обмена (нейтрализации).
Многокислотные основания могут в таких реакциях давать как средние, так и основные соли.
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду.
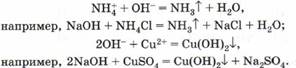 5. Взаимодействуют с амфотерными оксидами и гидроксидами:
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
 7. Вступают в реакции с некоторыми органическими веществами, например с фенолом — карболовой кислотой:
7. Вступают в реакции с некоторыми органическими веществами, например с фенолом — карболовой кислотой:
|
|
|


