 |
Особенности твердого состояния неорганических красителей
|
|
|
|
В первую очередь следует помнить, что неорганические красители, как природные, так и синтетические,— кристаллические тела. Особенностью их является упорядоченное расположение многих сотен и тысяч атомов, ионов или молекул. Различаются они как по типу входящих в твердое тело частиц, так и по типу химических связей между ними.
Для того чтобы понять их структуру, рассмотрим на знакомых из школьного курса химии примерах особенности того или иного вида построения агрегатных состояний.
В газообразном состоянии вещества характеризуются значительными расстояниями между частицами и малыми силами взаимодействия между ними. Они способны занимать любой предоставленный объем, и их свойства в основном определяются поведением отдельных частиц. В жидком же состоянии частицы веществ сближены на расстояния, соизмеримые с их размерами, силы взаимодействия между частицами значительны. Частицы вещества объединяются в крупные агрегаты, в которых их взаимное расположение упорядоченное и движение носит колебательный характер (ближний порядок). На значительных расстояниях от центров агрегатов (дальний порядок) эта упорядоченность нарушается. Прочность связей между агрегатами частиц в жидкости невелика, поэтому в жидком состоянии вещество занимает определенный объем, но способно изменять форму под действием силы тяжести. Поведение веществ в этом состоянии определяется как свойствами частиц и их агрегатов, так и взаимодействиями между ними.
В твердом состоянии возникает упорядоченное расположение частиц как в ближнем, так и в дальнем порядках. Твердое вещество не только способно сохранять определенный объем, но и неизменность формы под действием силы тяжести. Свойства вещества определяются как его элементарным составом, так и структурой. Взаимное расположение частиц в твердом веществе характеризуется расстоянием между центрами, вокруг которых они совершают колебательные движения. Упорядоченное расположение атомов (рис. 4), многократно повторяющееся вдоль любой прямой линии, называется кристаллической решеткой.
|
|
|

Рис. 4. Основные типы кристаллических решеток:
а — гексагональная плотнейшая; б — кубическая гранецентрированная; в — кубическая объемноцентрированная; г — кристаллическая решетка типа алмаза.
В природе встречается значительное число форм кристаллических решеток; их изучением занимается специальная область науки — кристаллография. По характеру взаимодействия между частицами в решетках кристаллические вещества можно разделить на несколько основных групп.
1. Ионные кристаллы. В узлах решеток расположены разноименно заряженные ионы, электростатическое притяжение которых определяет характер твердого тела (например, КСl, NaCl).
2. Атомные кристаллы. В узлах решеток - нейтральные атомы элементов, связанные за счет обобществления валентных электронов (например, алмаз).
3. Молекулярные кристаллы. В узлах решеток — нейтральные молекулы, образующие решетку за счет сил межмолекулярного взаимодействия (например, металлический галлий, газы в твердом состоянии).
4. Полупроводниковые кристаллы. По характеру связи занимают промежуточное положение между атомными и ионными (например, Cu2 O).
5. Металлические кристаллы. В узлах решетки — ионы одного и того же металла, связанные между собой за счет полусвободных электронов, находящихся в общей для всех ионов зоне проводимости.
Цвет металлов
Цвет металлов зависит от того, волны какой длины они отражают. Из спектров, приведенных на рисунке 5, видно, что белый блеск серебра обусловлен равномерным отражением почти всего набора видимых лучей. Золото красновато-желтое потому, что им отражается почти полностью длинноволновая часть видимого света и поглощаются голубые, синие и фиолетовые лучи. А вот тантал и свинец лучше отражают длинноволновые лучи, поэтому они кажутся синеватыми. К серебристо-белому цвету висмута и кобальта примешивается розовый оттенок из-за разности в поглощении коротких и длинных лучей; как можно видеть из рисунка, отражение постепенно уменьшается от длинных волн к коротким. Убедительными примерами взаимодействия света с электронами, при которых происходит перевод их на более высокий уровень и даже полный отрыв, являются полупроводники и фотоэлементы. В первом случае действие лучей способно вызвать перемещение электронов и появление тока, а во втором — вырвать их из металла.
|
|
|
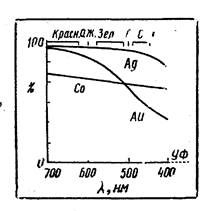
Рис. 5. Спектры отражения металлов.
Цвет металла зависит от того, какой длины световые волны он поглощает и отражает: кобальт — розовый, серебро — белое, золото — желтое.
Большинство неорганических веществ, обладающих цветом, так или иначе связано с ионами металлов, а сами металлы представляют один из типов простых веществ, имеющих цвет, то, по-видимому, логично будет рассмотреть зависимость цвета металла от его структуры.
В периодической системе, начиная со II периода, металлы расположены во всех группах с первой по восьмую. Естественно, что характер членов этих групп меняется от одной группы к другой и от периода к периоду. Однако несмотря на большое разнообразив свойств, у металлов есть качества, присущие всем металлическим веществам без исключения. Одной из замечательных особенностей является наличие окрашенных соединений у всех переходных металлов. Зависимость окраски от наличия свободных d-орбиталей на предвнешнем уровне атомов металла можно объяснить следующим образом. Как известно, в d-подуровни имеется пять орбиталей. Они имеют разные, но совершенно определенные положения в пространстве. На каждой из этих пяти орбиталей может находиться в соответствии с принципом Паули но дна электрона. Причем если у атома (или иона) имеются пять или меньше электронов на d-подуровне, то каждый из них старается занять отдельную орбиталь. В этом случае их энергия наименьшая из всех возможных. Если электронов становится больше пяти, то происходит спаривание, сопровождающееся переходами электронов. Энергия таких переходов электронов соответствует энергиям квантов видимого света. Поглощение таких квантов из солнечного белого света и определяет цвет Сu2+, Fe2+, Fe3+, Co2+, Ni2+, Cr3+, Mn3+, Mn4+, Mn6+, Mn7+ других окрашенных ионов переходных элементов.
|
|
|
Наполовину и менее заполненные внутренние электронные орбитали дают простор для переходов электронов.
|
|
|


