 |
III.2 Влияние температуры, а также энтальпийного и энтропийного факторов на возможность самопроизвольного протекания реакций
|
|
|
|
Часто необходимо проанализировать возможность самопроизвольного протекания реакций вдали от 298К, то необходимо продифференцировать, а затем проинтегрировать выражения для F и G. Рассмотрим на примере изобарно-изотермического потенциала:
G° = H° – T·S°
Дифференцирование в изотермических условиях дает: dG° = dH° – T·dS°.
Интегрируем при Т = const:
ΔG°р-ции = ΔH°р-ции - T·ΔS°р-ции. (18)
Эту формулу приходится применять не только для расчета ΔG°р-ции при некоторой заданной температуре Т, но и для поиска оптимальных с термодинамической точки зрения температурных условий для той или иной реакции. Если считать, что ΔH°р-ции и ΔS°р-ции мало зависят от температуры, то уравнение для ΔG°р-ции становится уравнением прямой со свободным членом (ΔH°р-ции втой или иной степени всегда отличается от нуля). Наклон прямой (угловой коэффициент) определяется величиной ΔS°р-ции. При этом знак и абсолютное значение ΔG°р-ции зависят от знаков, абсолютных значений ΔH°р-ции и ΔS°р-ции, а также от температуры.
Проанализируем вначале влияние температуры.
Для этого продумаем вид формулы (18) для крайних температурных условий:
| Т → 0К | Т → ∞ | Итоговый вывод | ||
| ΔG°р-ции = ΔH°р-ции | ΔG°р-ции = - T·ΔS°р-ции | |||
| ΔH° < 0, ΔS° > 0 | ΔG°р-ции < 0 Реакция возможна | ΔG°р-ции < 0 Реакция возможна | Реакция термодинамически выгодна во всем интервале температур | |
| ΔH° > 0,ΔS° > 0 | ΔG°р-ции > 0 Реакция невозможна | ΔG°р-ции < 0 Реакция возможна | Реакция термодинамически выгодна при высоких температурах Т > Т* | |
| ΔH° < 0,ΔS° < 0 | ΔG°р-ции < 0 Реакция возможна | ΔG°р-ции > 0 Реакция невозможна | Реакция термодинамически выгодна при низких температурах Т < Т* | |
| ΔH° > 0,ΔS° < 0 | ΔG°р-ции > 0 Реакция невозможна | ΔG°р-ции > 0 Реакция невозможна | Реакция термодинамически невыгодна во всем интервале температур | |
Как видно, при одинаковых знаках ΔH°р-ции и ΔS°р-ции при повышении температуры может измениться знак ΔG°р-ции. Смена знака происходит при равновесной температуре реакции, для которой выполняется условие
|
|
|
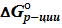 =
= 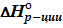 – T *
– T *  = 0, отсюда
= 0, отсюда 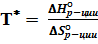 . (19)
. (19)
 Примеры:
Примеры:
| Рис.8 - Варианты температурных зависимостей ΔG реакций при условии неизменности значений ΔН и ΔS |
2KClO3 (кр) = 2KCl(кр) + 3O2 (г)
ΔH° = -98 кДж/моль,
ΔS° = 495 Дж/(моль·К)
Электрический ток в цепи со свинцовым (автомобильным) аккумулятором возникает за счет самопроизвольно идущей реакции:
PbO2 (кр) + Pb(кр) + H2SO4(aq) = 2PbSO4 (кр) + 2H2O(ж)
ΔН° = -319.6 кДж/моль, ΔS° = 258.9 Дж/(моль·К)
II: DH°>0, DS°>0. Такие реакции с термодинамической точки зрения выгодно проводить при более высоких температурах.
СаСО3 (кр) = СаО(кр) + СО2 (г) ΔH° = 178 кДж/моль, ΔS° = 164.7 Дж/(моль·К)
T * = 1080.7 К» 800 °C
III: ΔН°<0, ΔS°<0. Энтропийный фактор не способствует протеканию реакции, поэтому более вероятным переход становится при низких температурах (на рис.6 – при температурах ниже Ткрит.1
N2 (г) + 3H2 (г) = 2NH3 (г) ΔН° = -92.4 кДж/моль, ΔS° = -206.2 Дж/(моль·К)
T * = 448.1 К» 175 °C
IV: ΔH°>0, ΔS°<0. Для таких реакций DG°>0 при любых температурах, поэтому часто говорят, что самопроизвольное протекание таких реакций невозможно. Однако в соответствии со смыслом II-го начало термодинамики такие процессы, как уже отмечалось ранее, все же возможны, но маловероятны. Полнота протекания таких реакций невелика. В заметной степени они могут быть выполнены только за счет совершения принуждающей работы или в сопряжении с каким-то самопроизвольным процессом, для которого ΔG°<<0. Примером может служить зарядка свинцового аккумулятора за счет работы внешнего источника напряжения:
|
|
|
2PbSO4 (кр) + 2H2O(ж) = PbO2 (кр) + Pb(кр) + H2SO4 (aq).
ΔH° = 319.6 кДж/моль, ΔS° = -258.9 Дж/моль·К.
|
|
|


