 |
Электрохимические и электролитические ячейки. Электроаналитические методы
|
|
|
|
ЛЕКЦИЯ 8
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ И ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ АНАЛИЗА
| 9.1. Окислительно-восстановительная пара. Редокс-потенциал |
| 9.2. Электрохимическая и электролитическая ячейки. Электроаналитические методы |
| 9.3. Направление реакций окисления-восстановления |
| 9.4. Факторы, влияющие на величину редокс-потенциала |
| 9.5. Константа равновесия окислительно-восстановительных реакций |
| 9.6. Окислительно-восстановительные реакции в анализе |
1. Окислительно-восстановительная пара. Редокс-потенциал.
2. Электрохимическая и электролитическая ячейки. Электроаналитические методы.
3. Направление реакций окисления-восстановления.
4. Факторы, влияющие на величину редокс-потенциала.
5. Константа равновесия окислительно-восстановительных реакций.
6. Окислительно-восстановительные реакции в анализе.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ ПАРА.
РЕДОКС-ПОТЕНЦИАЛ
Окислительно-восстановительные реакции происходят с переносом электронов, т.е. сопровождаются изменением степени окисления элемента. При этом восстановители окисляются, отдают электроны. Окислители – восстанавливаются, принимают электроны. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Т.е. окислительно- восстановительная реакция
2Fe3+ + Sn(II) ó 2Fe2+ + Sn(IV)
может быть представлена двумя полуреакциями:
2Fe3+ + 2℮ ó 2Fe2+ – полуреакция восстановления, в ходе которой окислитель (ионы железа) переходит из своей окисленной формы в восстановленную;
Sn(II) – 2℮ ó Sn(IV) – полуреакция окисления, в ходе которой восстановитель (ионы олова) переходит из своей восстановленной формы в окисленную.
|
|
|
При протекании окислительно-восстановительной реакции обязательно должно быть две редокспары.
Совокупность окисленной и восстановленной форм элемента называется редокс-парой.
Редокс-пара обозначается в виде дроби следующим образом:
Sn(IV)/Sn(II) и Fe3+/Fe2+,  т.е. в числителе – окисленная форма, в знаменателе – восстановленная форма.
т.е. в числителе – окисленная форма, в знаменателе – восстановленная форма.
В общем виде редокс-пара записывается ox/red. В любой окислительно-восстановительной реакции участвует не менее двух редокс-пар.
Для характеристики окислительно-восстановительной способности пары пользуются величиной окислительно-восстановительного (или редокс) потенциала. Редокс-потенциал обозначается  и измеряется в вольтах.
и измеряется в вольтах.
Экспериментально определить редокс-потенциал отдельно взятой пары нельзя. Можно измерить разность потенциалов, т.е. величину одного потенциала относительно другого. Но тогда какой-то один из потенциалов пары необходимо выбрать за стандартный, т.е. за точку отсчета.
Такой парой условились считать систему 2Н+ + 2℮ ó H2 (водородный электрод). При а(Н+) = 1моль/л, давлении водорода 1атм потенциал пары водорода  принято считать равным нулю при любой температуре.
принято считать равным нулю при любой температуре.
Устройство водородного электрода представлено на рис. 9.1.
 |
Рис. 9.1. Водородный электрод
Водородный электрод представляет собой стакан, заполненный 1,25 М раствором соляной кислоты или 1 н H2SO4. Активность ионов водорода в растворе а(Н+) = 1моль/л. В раствор HCl опущен электрод из платины (обозначен цифрой 1), покрытый мелкодисперсной платиной («чернью»). В стакан пропускают газообразный водород (стрелки) под давлением 1 атм (101,3 кПа). Платиновая чернь хорошо адсорбирует газообразный водород. На электроде происходит реакция 2Н+ + 2℮ ó H2. Возникает потенциал окислительно-восстановительной пары 2Н+/Н2, который условно принят за нуль.
Если составить гальванический элемент (или собрать электрохимическую ячейку) из водородного электрода и электрода, составляющую какую-либо окислительно-восстановительную пару, то э.д.с. такого элемента служит количественной оценкой окислительно-восстановительной способности пары.
|
|
|
Например, если хотят измерить потенциал пары Zn2+/Zn, то собирают электрохимическую цепь (рис. 9.2).
 Рис. 9.2. Электрохимическая ячейка:
Рис. 9.2. Электрохимическая ячейка:
1 – раствор соли Zn2+ (М2+); 2 – металлический цинк (М); 3 – устройство для измерения напряжения; 4 – солевой мостик или электролитический ключ (насыщенный раствор KCl в агар-агаре), который обеспечивает электрический контакт между двумя сосудами и предотвращает прямое взаимодействие содержимого обоих полуэлементов; СВЭ – стандартный водородный электрод
Редокспотенциал, измеренный в стандартных условиях относительно водородного электрода, называется стандартным или нормальным потенциалами и обозначаются Е°.Их величина для температуры 25°С приведена в справочнике.
Схематично собранный гальванический элемент согласно решению ИЮПАК записывают следующим образом:
(–) Zn│ZnSO4 ║H2SO4 │ (H2) Pt (+)
Формулы веществ, находящихся в одном растворе, записывают через запятую, а границу между электродом и раствором или между разными растворами обозначают вертикальной чертой │. Двойная вертикальная черта ║ показывает, что так называемый диффузный потенциал, возникающий на поверхности раздела растворов разного состава, сведен к минимуму или элиминирован с помощью солевого мостика.
На аноде происходит растворение цинковой пластинки:
Zn → Zn2+ + 2℮
На катоде – восстановление водорода:
2Н+ + 2℮ → H2
Если во внешней цепи ячейке поток электронов направлен от цинкового электрода к стандартному водородному электроду, то потенциал пары Zn2+/Zn условно принят за отрицательную величину (ему приписывают отрицательный знак) и наоборот. Так, стандартный электродный потенциал пары цинка  = – 0,76 В.
= – 0,76 В.
ЭЛЕКТРОХИМИЧЕСКИЕ И ЭЛЕКТРОЛИТИЧЕСКИЕ ЯЧЕЙКИ. ЭЛЕКТРОАНАЛИТИЧЕСКИЕ МЕТОДЫ
Механизм переноса электричества в ячейке на различных участках цепи неодинаков. В электродах и во внешних проводниках электричество переносится электронами, они движутся от анода к катоду. В растворе электричество переносится ионами. Цепь замыкается за счет того, что ионная проводимость на поверхности электродов переходит в электронную. Измерительное устройство во внешней цепи может быть пассивное, а может быть и активное – можно контролировать и регулировать направление и глубину протекания окислительно-восстановительной реакции.
|
|
|
Ячейки бывают двух типов:
Гальванический элемент -это ячейка, которая работает самопроизвольно и служит источником электрической энергии, возникающей за счет протекания в ней химических реакций.
Эту же ячейку можно присоединить к внешнему источнику напряжения. В этом случае, приложив достаточное напряжение, можно изменить направление окислительно-восстановительной реакции и заставить протекать ток в противоположном направлении.
Электрохимическую ячейку, являющуюся потребителем энергии, необходимой для протекания в ней химических реакций, называют электролитической ячейкой.
Независимо от режима работы ячейки, один из электродов должен обратимо реагировать на изменение концентрации вещества (индикаторный электрод), а потенциал второго электрода должен быть устойчив, воспроизводим и не зависеть от состава раствора. Второй электрод называется электродом сравнения, это точка отсчета измеряемого параметра индикаторного электрода.
Измеряемые параметры электрохимической ячейки положены в основу классификации электроаналитических методов (табл. 9.1).
Таблица 9.1. Электроаналитические методы
| Измеряемый параметр электрохимической ячейки | Условия измерения | Метод |
| Потенциал Е, В. | I=0 | Потенциометрия |
| Ток I, А | I= f (Eвнеш.) | Вольтамперометрия |
| Количество электричества Q, Кл | I=const или Е=const | Кулонометрия |
| Удельная электрическая проводимость æ, См·см–1 | I~, 1000 Гц | Кондуктометрия |
| Масса m, г | Е=const | Электрогравиметрия |
Вернемся к стандартным или нормальным потенциалам. Они представлены ниже на рис. 9.3 в виде диаграммы окислительно-восстановительных потенциалов (в вольтах).
Величины стандартных редокс-потенциалов, приведенные в справочнике, не зависят от концентрации реагентов и ионной силы и являются термодинамическими константами. На диаграмме (рис. 9.3) они расположены в порядке возрастания от – 1,66 В до + 1,84 В.
|
|
|
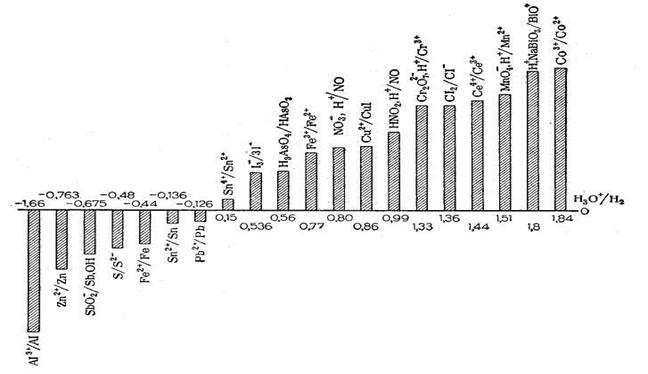
Рис. 9.3. Диаграмма стандартных редокс-потенциалов
Общее правило:
чем больше величина стандартного редокс-потенциала, тем более сильным окислителем является окисленная форма пары и тем более слабым восстановителем является ее восстановленная форма.
Наиболее сильные окислители сгруппированы справа в таблице (BiO3–, MnO4–, Cr2O72–). Окисленные формы висмута, марганца и хрома являются сильнейшими окислителями. В то же время восстановленные формы этих элементов являются очень слабыми восстановителями. Сильные восстановители сгруппированы в левой части таблицы.
Каждый окислитель может окислять вещества, стоящие левее его в таблице (т.е. с меньшими стандартными потенциалами). А каждый восстановитель может восстанавливать стоящие правее его вещества, т.е. с большими стандартными потенциалами. Например, стандартный потенциал системы  . Вещества, у которых Е° больше, чем у нитрит-ионов, их окисляют, например, KMnO4. А те вещества, у которых потенциал ниже – их восстанавливают, например, иодид-ионы:
. Вещества, у которых Е° больше, чем у нитрит-ионов, их окисляют, например, KMnO4. А те вещества, у которых потенциал ниже – их восстанавливают, например, иодид-ионы:

Величина потенциала пары в нестандартных условиях зависит от активностей окисленной и восстановленной форм аox и ared. Эта зависимость выражается уравнением Нернста:
 ,
,
где Е – потенциал пары в момент равновесия (В);
Е° – стандартный потенциал, т.е. потенциал при = 1 моль/л;
R – универсальная газовая постоянная (8,3144 Дж·град–1·моль–1);
F – число Фарадея (96493 Кл·моль–1);
Т – абсолютная температура (К);
n – число электронов, участвующих в полуреакции.
Постоянные величины и коэффициент перехода от натуральных логарифмов к десятичным (2,3) можно заменить температурным коэффициентом, равным при +20°С 0,059. Уравнение Нернста тогда можно представить так:

Строго говоря, активности аox и ared должны быть возведены в степень, равную стехиометрическому коэффициенту в уравнении полуреакции. Кроме того, под знак логарифма должны быть включены активности всех компонентов, сопровождающих окисленную или восстановленную формы, за исключением воды, твердых веществ, свободных металлов и газов. Твердые вещества, молекулы растворителя или свободные металлы в соприкосновении с раствором находятся в термодинамическом стандартном состоянии и их активность принимается равной 1.
|
|
|


