 |
Направление реакций окисления-восстановления
|
|
|
|
Окислительно-восстановительная реакция между двумя веществами протекает в направлении образования более слабых окисленных и восстановленных форм. Для определения направления необходимо сравнить Е° обеих пар, участвующих в реакции. Для этого нужно написать полуреакции в форме полуреакций восстановления и вычислить значение ΔЕ. Если ΔЕ = Е°1 – Е°2 > 0, реакция протекает слева направо, если ΔЕ < 0 – справа налево.
Например, определим, в каком направлении протекает реакция между Fe3+ и I–.
Полуреакции:
Fe3+ + ℮ ó Fe2+ (Е° = 0,77 B)
I2 + 2℮ ó 2I– (Е° = 0,53 B)
Вычитаем вторую полуреакцию из первой и переносим члены со знаком минус:
2Fe3+ + 2I– ó 2Fe2+ + I2; ΔE° = + 0,24 B
Следовательно, реакция протекает слева направо, т.е. с выделением иода I2. К такому же выводу мы пришли бы, вычитая первую реакцию из второй:
2Fe2+ + I2 ó 2Fe3+ + 2I–, ΔE = – 0,24 B.
Реакция протекает справа налево, т.е. с выделением I2.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ РЕДОКС-ПОТЕНЦИАЛА
1. Влияние электростатических взаимодействий. В этом случае уравнение Нернста можно представить так:

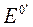 – формальный потенциал, который зависит от ионной силы раствора.
– формальный потенциал, который зависит от ионной силы раствора.
2. Температура. Из уравнения Нернста видно, что чем выше температура, тем больше величина потенциала.
3. Влияние pH. Если в окислительно-восстановительной реакции участвуют ионы водорода (например, если Ox или Red представляют собой кислородсодержащие соединения, кислоты или основания), то они могут влиять на направление реакции и константу равновесия. Например, для редокс-пары марганца уравнение Нернста можно представить следующим образом:
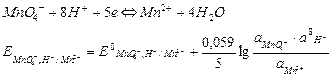

Сумма двух первых членов – формальный потенциал 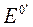 , зависящий от рН раствора.
, зависящий от рН раствора.
|
|
|
Меняя кислотность раствора, можно изменять направление реакций.
Например, установите по величине редокс-потенциала направление реакции AsO43– + 2H+ + 2I– ó AsO33– + I2 +H2O
при а) [ AsO43–] = [ AsO33–] = 1моль/л
[H+] = 1моль/л
б) [ AsO43–] = [ AsO33–] = 1моль/л
[H+] = 10–7моль/л
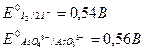
Редокс-потенциал пары мышьяка зависит от кислотности:
при [H+] = 1моль/л Е1= 0,56 + 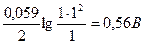 ;
;
при [H+] = 10–7моль/л Е2 = 0,56 + 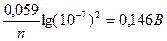
Таким образом, в кислой среде реакция идет слева направо (ΔE = 0,56 – 0,54 > 0), а в нейтральной среде – справа налево (ΔE = 0,146 – 0,54 < 0).
4. Влияние реакций образования малорастворимых соединений окисленной или восстановленной формами. Если в раствор ввести компонент А, связывающий одну из форм (или обе) в малорастворимое соединение, то образуется новая пара, например,
Ox + A ó OxA ↓ – побочная реакция;
OxA ↓ + ℮ ó Red + A – новая полуреакция;
Ox/Red, A – новая пара.
Например, при определении меди иодометрическим методом протекает реакция:
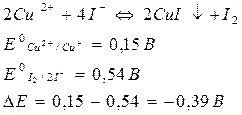
Реакция должна протекать справа налево. Однако реакция на самом деле идет в прямом направлении, т.е. слева направо. Это связано с тем, что стандартный потенциал меди связан с произведением растворимости CuI и активностью иодид-ионов:
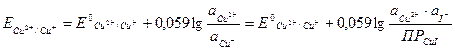
Концентрация Cu+ (восстановленной формы) в растворе сильно понижается – выпадает осадок. Редокс-потенциал новой пары 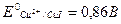 . Тогда ΔE = 0,86 – 0,54 > 0, т.е. реакция действительно идет слева направо.
. Тогда ΔE = 0,86 – 0,54 > 0, т.е. реакция действительно идет слева направо.
5. Влияние комплексообразования окисленной и восстановленной форм.
Если окисленная или восстановленная форма (или обе сразу) связываются в комплексное соединение с компонентом L, то образуется новая пара, стандартный потенциал которой связан с потенциалом пары Ox/Red через константу побочной реакции (в данном случае это константа устойчивости комплекса β). Например, добавление аммиака к раствору Cu2+ изменит значение редокс-потенциала пары меди:
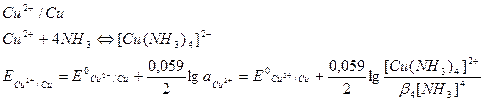
Если в комплекс связывается окисленная форма, то окислительная способность пары уменьшается. Аналогично, если связывается восстановленная форма, окислительная способность пары возрастает.
|
|
|
|
|
|


