 |
Кислородные соединения серы.
|
|
|
|
1. Получение диоксида серы
В прибор с Г-образной трубкой для получения газов насыпать 3-5 г сульфита натрия, увлажнить соль несколькими каплями воды и прилить немного концентрированной серной кислоты. В конце опыта можно слегка подогреть пробирку с реакционной смесью. Выделяющийся газ собрать методом вытеснения воздуха в большую сухую пробирку. Пробирку закрыть резиновой пробкой и сохранить для работы 2. Пропустить ток выделяющегося диоксида серы через разбавленный раствор фуксина. Наблюдать обесцвечивание фуксина. Полученный бесцветный раствор нагреть. Наблюдать появление прежней окраски. Объяснить происходящие явления.
2. Растворимость диоксида серы
Пробирку, наполненную диоксидом серы, закрыть пальцем и опрокинуть в кристаллизатор с водой. Убрать палец и наблюдать как вода начинает подниматься вверх, заполняя почти всю пробирку. Для ускорения растворения SO2 в воде пробирку можно слегка покачивать. Снова закрыть пробирку пальцем и вынуть из воды. Добавить к образовавшемуся раствору несколько капель индикатора метилоранжа. Что происходит?
3. Окислительно-восстановительные свойства сернистой кислоты
а) Налить в одну пробирку немного бромной воды, в другую – иодной воды, в третью – раствор перманганата калия, а в четвёртую – раствор дихромата калия, подкисленного серной кислотой. Затем во все пробирки добавить раствор сернистой кислоты до отчётливого изменения окраски. В трёх первых пробирках происходит обесцвечивание растворов, а в четвёртой – оранжевый цвет изменяется на зелёный.
б) Налить в пробирку раствор сернистой кислоты, подкисленной H2SO4 и добавить (Тяга!) раствор сульфида натрия. Наблюдать выделение серы в виде белой мути.
|
|
|
4. Водоотнимающее действие серной кислоты
Насыпать в маленький химический стакан 5-6 г сахарной пудры и поставить его в чашку Петри. Прилить к сахару немного воды до образования кашицы, затем 5-6 мл концентрированной серной кислоты и хорошо перемешать стеклянной палочкой. Объяснить причину обугливания сахара и увеличение объёма смеси.
5. Окислительные свойства серной кислоты. (Тяга)
а) Действие на металлы.
Подействовать разбавленной серной кислотой в отдельных пробирках на медь, цинк, алюминий. Если реакция протекает медленно, содержимое пробирки слегка подогреть. Какие металлы реагируют с разбавленной серной кислотой? Какой ион является окислителем?
Подействовать на те же металлы концентрированной серной кислотой, подогреть, отметить цвет и запах продуктов реакций. Какой ион является окислителем в данном случае?
б) Действие на сложные вещества.В две сухие пробирки поместить немного кристаллических KBr и KI. В каждую пробирку прибавить пипеткой несколько капель серной кислоты. Что происходит?
6. Реакции на ион 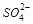
а) Налить в пробирку раствор хлорида бария и прилить разбавленную серную кислоту. Отметить цвет осадка. Испытать отношение полученного сульфата бария к кислотам и щелочам.
б) Повторить предыдущий опыт, заменив хлорид бария нитратом свинца.
7. Тиосульфат натрия и его свойства
а) К раствору тиосульфата натрия прилить разбавленной серной кислоты. Наблюдать выделение серы.
б) К раствору тиосульфата натрия прибавить бромной воды. Обратить внимание на исчезновение запаха хлора. До каких продуктов окисляется хлором тиосульфат-анион?
в) К раствору Na2S2O3 прилить немного иодной воды. Обратить внимание на исчезновение окраски. При составлении уравнения реакции учесть, что иод переводит тиосульфат в соль тетратионовой кислоты Na2S4O6. Эта реакция применяется для открытия тиосульфат аниона.
|
|
|
8. Свойства пероксодисульфата натрия
Приготовить в пробирке раствор, содержащий немного азотной кислоты (1:1), одну каплю (не больше) раствора соли Mn2+, 1-2 капли раствора нитрата серебра (в качестве катализатора). Прибавить в пробирку микрошпатель персульфата калия или натрия. Нагреть и наблюдать окисление Mn2+ до марганцевой кислоты HMnO4.
Контрольные вопросы и задачи
1. Как изменяется потенциал ионизации, сродство к электрону и свойства элементов шестой группы главной подгруппы? Почему?
5. Напишите уравнение диссоциации сероводородной кислоты. Как отразится на равновесии добавление к раствору: а) соляной кислоты, б) щелочи, в)нитрата свинца?
6. Как изменяются кислотные и окислительно-восстановительные свойства в ряду: а) Н2S – Н2Sе – Н2Те; б) Н2SО4 – Н2SеО4 – Н2ТеО4? Соли, какой кислоты будут подвергаться гидролизу в большей степени? В какой кислоте можно растворить золото?
7. На сульфид железа(П) подействовали: а) соляной кислотой, б) азотной кислотой. Напишите уравнения соответствующих реакций.
8. Приведите примеры: а) двух сульфидов растворимых в воде, б) нерастворимых в воде, но растворимых в кислоте, в) нерастворимых и в воде и в кислоте. Напишите уравнения реакций их получения.
9. Какие способы получения SО2 существуют? Какие ионы получаются при пропускании SО2 а) в чистую воду, б) хлорную воду?
10.Напишите графические формулы: тиосульфата натрия, дисульфата натрия, пероксодисульфата натрия. Могут ли эти соли принимать участие в окислительно-восстановительных процессах? Какую роль они могут выполнять при этом? Приведите примеры реакций.
11. Можно ли в качестве осушителя применять серную концентрированную кислоту для следующих газов: сероводорода, углекислого газа, бромоводорода, иодоводорода? Напишите уравнения соответствующих реакций.
12. Закончите уравнения реакций и расставьте коэффициенты:
Na2SO3 + I2 + H2O = SO2 + NO2 + H2O =
Na2SO3 + Fe2(SO4)3 + H2O = SO2 + Fe2(SO4)3 + H2O =
K2CrO4 + K2S + H2O = K2SO3 + Br2 + H2O =
K2S + H2O2 = SO2 + NaIO3 + H2O =
KClO3 + SO2 + H2O = KMnO4 + Na2S + KOH =
Na2SO3S + Cl2 + H2O = Na2SO3 + NaClO =
Bi + H2SO4 (конц.) = Mg + H2SO4 (конц.) =
Fe + H2SO4 (конц.) = Be + H2SO4 (конц.) =
C + H2SO4 (конц.) = Ag + H2SO4 (конц.) =
KMnO4 + FeSO3 + H2SO4 = KMnO4 + K2S + H2SO4 =
K2Cr2O7 + K2SO3 + H2SO4= H2SO3 + NO2 =
K2MnO4 + Na2S + H2O =
|
|
|


