 |
Основные параметры проводников
|
|
|
|
§ Удельная проводимость. Электропроводность обуславливается наличием свободных валентных электронов в проводнике. При подключении электрического напряжения, электроны будут двигаться от минуса к плюсу, что создаст электрический ток. Удельная проводимость покажет, в какой мере тот или иной материал проводит создавшийся ток.

§ Удельное сопротивление - обратная величина удельной проводимости - 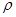 . Это величина, с помощью которой количественно оценивается электрическое сопротивление материала. Определяется из формулы:
. Это величина, с помощью которой количественно оценивается электрическое сопротивление материала. Определяется из формулы:

§ Температурный коэффициент удельного сопротивления металлов.

При повышении температуры число носителей заряда в проводнике остаётся практически неизменным. Но вследствие усилений колебаний узлов кристаллической решетки с ростом температуры, на пути направленного движения свободных электронов под действием электрического тока появляется всё больше препятствий, то есть уменьшаются средняя длина свободного пробега электрона  , подвижность электронов и, как следствие, уменьшается удельная проводимость и повышается удельное сопротивление.
, подвижность электронов и, как следствие, уменьшается удельная проводимость и повышается удельное сопротивление.
§ Теплопроводность -  . Обмен электронами между нагретыми и холодными частями металла в отсутствие электрического поля, переход кинетической энергии от нагретых частей проводника к более холодным. За передачу теплоты через металл в основном ответственны те же свободные электроны, которые определяют и электропроводность металлов.
. Обмен электронами между нагретыми и холодными частями металла в отсутствие электрического поля, переход кинетической энергии от нагретых частей проводника к более холодным. За передачу теплоты через металл в основном ответственны те же свободные электроны, которые определяют и электропроводность металлов.
§ Контактная разность потенциалов:

§ и термоэлектродвижущая сила (термо-ЭДС):

При соприкосновении двух различных металлических проводников между ними возникает контактная разность потенциалов. Причина появления этой разности потенциалов заключается в различии значений работы выхода электронов из различных металлов, а также в том, что концентрация электронов, а следовательно, и давление электронного газа у разных металлов и сплавов могут быть неодинаковыми. Термо-ЭДС возникает, когда один из спаев имеет температуру  , а другой -
, а другой -  .
.
|
|
|
Никель
Удельная проводимость никеля – 11,5 (Ом-1*см-1)
Удельное сопротивление никеля - 0,0685(Ом*мм2)/м
Температурный коэффициент удельного сопротивления 7,2*10-3 град-1
Теплопроводность 107 Вт/(м·К)
Никель — металл серебристо-белого цвета. По ряду свойств (температуре плавления, плотности, теплопроводности) он близок к железу и кобальту и характеризуется средней химической активностью. При обычной температуре в сухом воздухе никель заметно не реагирует с кислородом, но при нагревании до 500 °С окисляется довольно энергично. В порошкообразном состоянии никель пирофорен, т.е. воспламеняется на воздухе при обычной температуре.
Физические свойства
Никель – серебристо-белый с желтоватым оттенком металл, очень твердый, вязкий и ковкий, притягивается магнитом, проявляя магнитные свойства при температурах ниже 340° C
- плотность — 8,9 г/см3 (20 °C)
- температура плавления - 1453 °C
- удельная теплоемкость при 20°C - 0,440 кдж/(кг·К)
- теплопроводность при 25°C 90,1 вт/(м·К)
- удельное электросопротивление при 20°C 68,4 ном·м
- температура кипения — 3000 °C
- температурный коэффициент линейного расширения 13,3·10-6 (0-100 °C) Предел прочности при растяжении 400-500 Мн/м2
- предел упругости 80 Мн/м2
- предел текучести 120 Мн/м2
- твердость по Бринеллю 600- 800 Мн/м2
Никель вместе с Fe (3d64s2) и Со (3d74s2), также ферромагнетиками, относится к элементам с недостроенной 3d-электронной оболочкой (к переходным 3d-металлам). Электроны недостроенной оболочки создают нескомпенсированный спиновый магнитный момент, эффективное значение которого для атомов никеля составляет 6 μБ, где μБ - магнетон Бора. Положительное значение обменного взаимодействия в кристаллах Никеля приводит к параллельной ориентации атомных магнитных моментов, то есть к ферромагнетизму.
|
|
|
Применение
Никель — ценная легирующая добавка к стали. Он повышает прочность и одновременно пластичность сталей. Никель в сочетании с хромом обеспечивает высокую антикоррозионную стойкость сталей и повышает их теплоустойчивость. Широкое применение получили хромоникелевые нержавеющие и теплоустойчивые стали.
Известны также никелевые сплавы, в которых Ni является преобладающим элементом. К ним относят сплавы никеля с алюминием, хромом, марганцем, кремнием, предназначенные для изготовления нагревателей (алюмель, хромель-, нихром), сплав с железом - так называемый пермаллой, которому после специальной термической обработки сообщается высокая магнитная проницаемость, а также монель — сплав с медью, железом и марганцем, высокостойкий против коррозии.
Никель применяют также для никелирования железа и других металлов в качестве противокоррозионного и декоративного покрытия, для изготовления щелочных аккумуляторов и в качестве катализатора в разных химических процессах.
Чугуны, содержащие никель, используют в химическом машиностроении. Промышленное производство Ni начато более ста лет назад, при этом около 80% всего производимого никеля расходуют для производства сталей, легированных этим металлом, и никелевых сплавов.
Вольфрам
- температура плавления — 3695 K (3422 °C)
- плотность чистого вольфрама составляет 19,25 г/см³
- твердость по Бринеллю 488 кг/мм²
- удельное электрическое сопротивление при 20 °C — 55·10−9 Ом·м, при 2700 °C — 904·10−9 Ом·м
Вольфрам является одним из наиболее тяжелых, твердых и самых тугоплавких металлов[3]. В чистом виде представляет собой металл серебристо-белого цвета, похожий на платину, при температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Применение
Применение чистого металла и вольфрамсодержащих сплавов основано, главным образом, на их тугоплавкости, твердости и химической стойкости. Чистый вольфрам используется для изготовления нитей электрических ламп накаливания и электронно-лучевых трубок, в производстве тиглей для испарения металлов, в контактах автомобильных распределителей зажигания, в мишенях рентгеновских трубок; в качестве обмоток и нагревательных элементов электрических печей и как конструкционный материал для космических и других аппаратов, эксплуатируемых при высоких температурах. Быстрорежущие стали (17,5–18,5% вольфрама), стеллит (на основе кобальта с добавлением Cr, W, С), хасталлой (нержавеющая сталь на основе Ni) и многие другие сплавы содержат вольфрам. Основой при производстве инструментальных и жаропрочных сплавов является ферровольфрам (68–86% W, до 7% Mo и железо), легко получающийся прямым восстановлением вольфрамитового или шеелитового концентратов. «Победит» – очень твердый сплав, содержащий 80–87% вольфрама, 6–15% кобальта, 5–7% углерода, незаменим в обработке металлов, в горной и нефтедобывающей промышленности.
|
|
|
Вольфраматы кальция и магния широко используются во флуоресцентных устройствах, другие соли вольфрама используются в химической и дубильной промышленности. Дисульфид вольфрама представляет собой сухую высокотемпературную смазку, стабильную до 500° С. Вольфрамовые бронзы и другие соединения элемента применяются в изготовлении красок. Многие соединения вольфрама являются отличными катализаторами.
ЗАДАЧА 4
1. Укажите свойства заданных проводниковых материалов, область применения, кратко опишите материалы.
2. Приведите числовые значения основных параметров заданных материалов
Дано:
Фосфор
Фосфид галлия
Решение:
Фосфор
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации —главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор —один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни. Фосфор имеет несколько аллотропных модификаций – белый, красный, чёрный, коричневый, фиолетовый фосфор и др. Первые три из названных наиболее изучены. Белый фосфор – бесцветное, с желтоватым оттенком кристаллическое вещество, светящееся в темноте. Его плотность 1,83 г/см3. Не растворяется в воде, хорошо растворяется в сероуглероде. Имеет характерный чесночный запах. Температура плавления 44°С, температура самовоспламенения 40°С. Чтобы защитить белый фосфор от окисления, его хранят под водой в темноте (на свету идёт превращение в красный фосфор). На холоде белый фосфор хрупок, при температурах выше 15°С становится мягким и режется ножом. Молекулы белого фосфора имеют кристаллическую решётку, в узлах которой находятся молекулы Р4, имеющие форму тетраэдра.
|
|
|
Каждый атом фосфора связан тремя σ-связями с другими тремя атомами.
|
|
|


