 |
Клиническая фармакология гликопептидов
|
|
|
|
Группа гликопептидов включает два природных антибиотика - ванкомицин и тейкопланин. Рост интереса к гликопептидам обусловлен увеличением частоты нозокомиальных инфекций, вызванных грамположительными микроорганизмами.
Фармакодинамика. Гликопептиды обладают преимущественно бактериостатическим действием, механизм которого заключается в нарушении синтеза клеточной стенки бактерий.
Спектр активности. Обладают активностью в отношении большинства аэробных и анаэробных грамположительных микроорганизмов.
Ванкомицин активен по отношению Staphylococcus aureus (включая пенициллиназообразующие и метилциллинрезистентные стафилококки), Streptococcus spp. (включая штаммы, резистентные к пенициллину), Corynebacterium spp., Haemophilus influenzae.
Тейкопланин активен в отношении Staphylococcus aureus и коагулазонегативных штаммов Staphylococcus spp. (включая резистентные к метициллину и другим β-лактамным антибиотикам), Streptococcus spp., Enterococcus faecalis, Listeria monocytogenes, Corynebacterium spp., Clostridium difficile, Peptococcus spp. Устойчивы почти все грамотрицательные бактерии, микобактерии, вирусы, простейшие. Не имеют перекрёст- ной резистентности с другими антибиотиками.
При исследовании in vitro выявлены некоторые различия в уровне природной активности и приобретённой резистентности между препа-
ратами: более высокая активность тейкопланина в отношении S. aureus (в том числе метициллинрезистентных штаммов), стрептококков (включая S. pneumoniae) и энтерококков; а ванкомицина - в отношении коагулазонегативных стафилококков.
В последние годы в нескольких странах выделены S. aureus со сниженной чувствительностью к ванкомицину или к ванкомицину и тейкопланину.
Некоторые ванкомицинрезистентные штаммы энтерококков сохраняют чувствительность к тейкопланину.
|
|
|
Фармакокинетика
Ванкомицин. Основной путь введения внутривенный (внутримышечное назначение очень болезненно). При приёме внутрь ванкомицин практически не всасывается; используют в лечении псевдомембранозного колита.
Средняя терапевтическая концентрация препарата сохраняется в течение 8-10 ч после введения. После внутривенного введения объём распределения 0,4 л/кг, связь с белком 55%, практически не метаболизируется. При интраперитонеальном введении в дозе 30 мг/кг концентрация в плазме крови около 10 мг/кг. Около 60% дозы абсорбируется через 6 ч. При многократном введении отмечается кумуляция. Препарат быстро проникает в полость перикарда, плевры, синовиальную и асцитическую жидкости (концентрация 50-100% плазменной). При менингитах концентрация ванкомицина в цереброспинальной жидкости составляет 10-20% плазменной. Обнаруживается в жёлчи (50% концентрации в крови), с калом выделяется в незначительном количестве. Основной путь выведения (90%) - клубочковая фильтрация. Концентрация в моче 100-300 мкг/мл. Т1/2 - 4-6 ч (у больных с нормальной фукнкцией почек). У больных со сниженной функцией почек и у пожилых Т1/2 - 7,5 дней. 75% дозы экскретируется в первые
24 ч.
Тейкопланин®. Биодоступность после внутримышечного введения 3-6 мг/кг - 90%. Т1/2 40-70 ч позволяет назначать его один раз в сутки, после внутривенного введения 3-6 мг Т1/2 - 150 ч. Связь с белками плазмы 90-95%. Экскреция почками - 80%.
Гликопептиды не метаболизируются. Выводятся почками в неиз- менённом виде, при почечной недостаточности требуется коррекция доз. Препараты не удаляются при гемодиализе.
Нежелательные лекарственные реакции
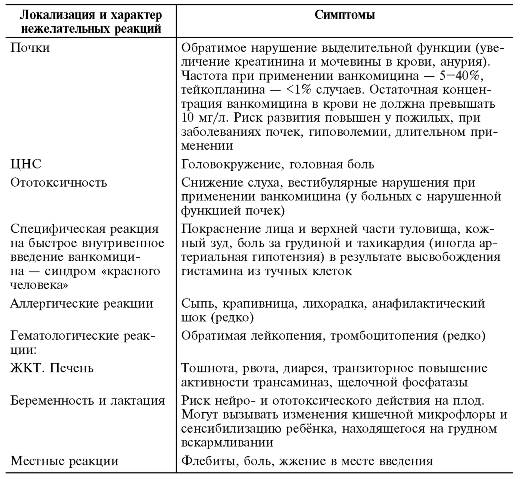
Побочные эффекты гликопептидов представлены в табл. 26-16.
Таблица 26-16. Нежелательные лекарственные реакции гликопептидов
 Показания
Показания
Показания к применению гликопептидов: при инфекциях, вызванных метициллинрезистентными S. aureus, а также энтерококками, резистентными к ампициллину и аминогликозидам, гликопептиды являются препаратами выбора.
|
|
|
• Инфекции, вызванные метициллинрезистентными S. aureus.
• Стафилококковые инфекции при аллергии к β-лактамам.
• Тяжёлые инфекции, вызванные Enterococcus spp., C. jeikeium, B. cereus, F. meningosepticum.
• Инфекционный эндокардит, вызванный зеленящими стрептококками и S. bovis при аллергии к β-лактамам.
• Инфекционный эндокардит, вызванный E. faecalis (в комбинации с гентамицином).
• Менингит, вызванный S. pneumoniae со сниженной чувствительностью к пенициллину.
• Эмпирическая терапия угрожающих жизни инфекций при подозрении на стафилококковую этиологию:
- инфекционный эндокардит трикуспидального клапана или протезированного клапана (в сочетании с гентамицином);
- катетер-ассоциированный сепсис;
- посттравматический или послеоперационный менингит (в сочетании с цефалоспоринами третьего поколения или фторхинолонами);
- перитонит при перитонеальном диализе;
- фебрильная нейтропения (при неэффективности стартовой терапии).
• Внутрь при антибиотикоассоциированной диарее, вызванной C. difficile.
Профилактическое применение - периоперационная профилактика при ортопедических и кардиохирургических операциях с высокой частотой распространения метициллинрезистентных S. aureus или при аллергии на β-лактамы; профилактика эндокардита у пациентов, относящихся к группе высокого риска.
Противопоказания
Гиперчувствительность к гликопептидам.
Лекарственные взаимодействия
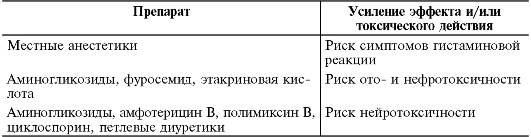
Лекарственные взаимодействия гликопептидов приводятся в табл. 26-17.
Таблица 26-17. Лекарственные взаимодействия гликопептидов
 Фузидовая кислота
Фузидовая кислота
Как и гликопептиды, является антибиотиком резерва при инфекциях, вызванных штаммами стафилакокка, резистентными к пенициллину и другим антибиотикам.
Бактериостатический препарат узкого спектра действия. Высокоактивен в отношении Staphyloccocus spp., Neisseria meningitidis, Neisseria gonorrhoeae, менее активен в отношении Streptoccus spp., в том числе Streptoccus pneumoniae. Эффективен в отношении Staphyloccocus, устойчивых к пенициллинам, стрептомицинам, хлорамфениколу, эритромицину; Neisseria spp. Haemophilus spp., Moraxella spp., Corynebacteria spp.
Обладает слабым противовирусным действием (адено-, риновирусы, вирус осповакцины). Не активен в отношении грамотрицательных бактерий, а также простейших и грибов.
|
|
|
Фармакокинетика
Препарат эффективен при приёме внутрь, хорошо всасывается (особенно натощак). Максимальная концентрация в крови определяется через 2-3 ч, средняя терапевтическая концентрация сохраняется на протяжении 24 ч. При повторных приёмах может кумулировать. Препарат можно вводить внутривенно. При приёме внутрь в дозе 0,5 г 2 раза в день концентрация стабилизируется на уровне 20 мкг/мл, при дозе 1 г 2 раза в день - 55-60 мкг/мл. Хорошо проникает в ткани и жидкости организма. Уровень антибиотика в лёгких, почках, костях, плевральном экссудате, хрящах, соединительной ткани составляет 30-50% от уровня в крови. Благодаря высокой липофильности обнаруживается в высоких концентрациях в очагах воспаления (40-60% уровня в крови), в секвестрах. Проникает через плацентарный барьер, в незначительных количествах обнаруживается в молоке матери. Не проходит через ГЭБ. С белками связывается на 90%. Фузидин* выделяется из организма с жёлчью, где обнаруживается в высоких концентрациях. Метаболизируется в печени до неактивных метаболитов. С мочой выводится лишь 0,1% принимаемого препарата, концентрация в моче составляет 0,3-0,8 мкг/мл. С калом экскретируется 10-15% принимаемого внутрь антибиотика.
Нежелательные лекарственные реакции
Фузидин - малотоксичный препарат. У 20% больных развивается диспепсия, редко требующая отмены препарата. Иногда наблюдаются аллергические реакции (кожная сыпь, эозинофилия).
Оксазолиденоны
Оксазолиденоны - новый класс синтетических антимикробных ЛС. В настоящее время в клинической практике применяется один из этих препаратов - линезолид.
Механизм действия оксазолиденонов связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других
антибиотиков, ингибирующих синтез белка, они действуют на ранних этапах трансляции (необратимое связывание с 30S- и 50S-субъедини- цей рибосом), вследствие чего нарушаются процесс образования 70S- комплекса и формирование пептидной цепи. В результате уникального механизма действия не отмечается перекрёстной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и хлорамфеникол).
|
|
|
Проявляет высокую антимикробную активность преимущественно в отношении грамположительных микроорганизмов - стафилококков, энтерококков, пневмококков, различных стептококков (группы А, В, С и viridans), анаэробных кокков, клостридий и некоторых других микроорганизмов. Большая часть грамотрицательных микроорганизмов природно-устойчива к линезолиду. Умеренную активность линезолид проявляет в отношении некотрых грамотрицательных микроорганизмов (минимальная подавляющая концентрация 4 мг/л и выше): M. catarrhalis, H. influenzae, B. pertussis, N. gonorrhoeae, Legionella spp.
Критерии чувствительности грампожительных микроорганизмов к линезолиду:
• энтерококки - чувствительные, промежуточные и устойчивые (соответственно <2, 4 и >8 мг/л);
• стафилококки - чувствительные (<4 мг/л);
• пневмококки - чувствительные (<2 мг/л);
• золотистый и коагулазонегативные стафилококки - чувствительные (1-2 мг/л).
В отношении энтерококков линезолид действует бактериостатически: проявляет стабильную активность в отношении E. faecalis, E. faecium и других энтерококков со значением минимальной подавляющей концентрации 1-4 мг/л, в том числе сохраняет активность в отношении штаммов энтерококков, резистентных к ванкомицину и тейкопланину®.
Линезолид проявляет активность (при одинаковых значениях минимальной подавляющей концентрации) в отношении метициллинчувствительных и метициллинрезистентных стафилококков; в отношении S. aureus и коагулазонегативных стафилококков проявляет бактериостатическое действие.
Активен в отношении как чувствительных штаммов S. pneumoniae, так и штаммов, устойчивых к пенициллину, эритромицину, цефтриаксону, клиндамицину, тетрациклину, хлорамфениколу. В последние годы выделены штаммы S. pneumoniae со сниженной чувствительностью к линезолиду.
В отношении анаэробных бактерий линезолид проявляет бактерицидный эффект: активность в отношении грамположительных анаэробов (C. perfringens, C. difficile) и пептострептококков сравнима с активностью ванкомицина в отношении этих микробов, но в отличие от последнего линезолид действует также на грамотрицательные анаэробы (B. fragilis, Fusobacterim spp., Prevotella spp.).
Линезолид высокоактивен в отношении Bacillis spp. (минимальная подавляющая концентрация 0,5-1 мг/л), Corynobacterium spp. (минимальная подавляющая концентрация 0,25-0,5мг/л), L. monocytogenes (минимальная подавляющая концентрация 0,5-2 мг/л), M. tuberculosis (минимальная подавляющая концентрация 0,5-2 мг/л), Nocardia spp. (минимальная подавляющая концентрация 2-4 мг/л).
|
|
|
In vitro линезолид проявляет слабый постантибиотический эффект. В отношении метициллинрезистентных S. aureus, MSSA и ванкомицинрезистентного постантибиотический эффект составляет при одной минимальной подавляющей концентрации 0,5; 0,3; 0,8; при четырёх минимальных подавляющих концентрациях - 0,6; 1,1; 1,4 соответственно. Постантибиотический эффект in vitro увеличивается при увелечении дозы ЛС и составляет при 20 и 80 мг/кг в отношении пенициллинчувствительных S. pneumoniae 3,6 и 3,8 ч, в отношении MSSA - 3,9 и 3,7 ч соответственно.
Резистентность к линезолиду развивается медленно. Пока частота выделения штаммов микроорганизмов, устойчивых к линезолиду, существенно меньше, чем к ванкомицину и тейкопланину.
Фармакокинетика
При приёме внутрь быстро и хорошо всасывается. Биодоступность составляет около 100%, не зависит от приёма пищи. Максимальные концентрации в крови достигаются через 1-2 ч, распределяется во многих тканях и средах организма. При многократном применении отношение плазменной концентрации к концентрации в бронхиальном секрете и альвеолярной жидкости составляет соответственно 1,0: 4,5 и 1,0: 0,15. При однократном применении при отсутствии воспаления мозговых оболочек отношение концентрации линезолида в спинномозговой жидкости к плазменной концентрации составило 0,7:1,0. Связь с белком 31%. Метаболизируется в печени. Экскретируется преимущественно с мочой, в основном в неактивном состоянии. Т1/2 составляет 4,5-5,5 ч, не зависит от возраста пациента и функций печени и почек.
Показания
Эффективность линезолида в контролируемых исследованиях установлена при различных инфекциях, вызванных грамположительны-
ми микроорганизмами (пневмония, инфекции кожи и мягких тканей, мочевыводящих путей, интраабдоминальные инфекции, эндокардит, сепсис). Однако прежде всего его применение показано при инфекциях различной локализации, вызванных мультирезистентными грамположительными бактериями (прежде всего стафилококками и энтерококками).
Сравнительная клиническая эффективность ванкомицина и линезолида одинакова, но линезолид лучше переносится больными. При инфекциях, вызванных мультирезистентными грамположительными и грамотрицательными бактериями, используется комбинация линезолида с цефалоспоринами третьего и четвёртого поколения или фторхинолонами.
|
|
|


