 |
Клиническая фармакология хинолонов и фторхинолонов
|
|
|
|
Хинолоны, являющиеся синтетическими антибактериальными препаратами, делятся на четыре поколения, причём три последних являются фторированными (фторхинолоны). Классификация препаратов и спектр антимикробной активности представлены в табл. 26-19.
Таблица 26-19. Классификация и антимикробный спектр хинолонов и фторхинолонов
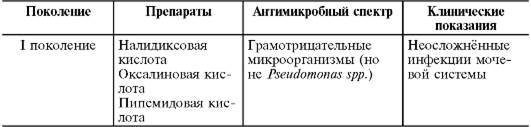 Окончание табл. 26-19
Окончание табл. 26-19
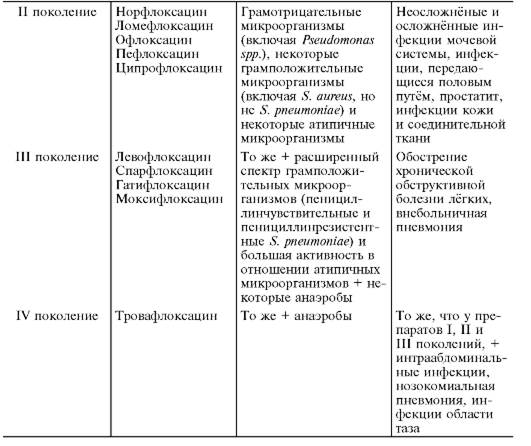 Хинолоны
Хинолоны
Хинолоны I поколения имеют узкий спектр активности, и многие из них (оксолиновая и пипемидовая кислоты) в настоящее время утратили своё значение.
Налидиксовая кислота - первый 4-хинолон, синтезированный в 1962 г. Действует бактерицидно, в низких концентрациях возможно также бактериостатическое действие.
Спектр активности. К налидиксовой кислоте высокочувствительны грамотрицательные бактерии (кроме синегнойной палочки), природно-устойчивы грамположительные.
Фармакокинетика. При приёме внутрь препарат хорошо всасывается. В печени после гидроксилирования образуется активная форма - гидроксиналидиксовая кислота, связывающаяся в крови на 80-90% с белками, что обусловливает плохое проникновение препарата в ткани. Антимикробным действием обладает лишь свободная фракция, на-
капливающаяся в достаточной концентрации лишь в мочевых путях. Активность усиливается при ощелачивании мочи. При сохранённой функции почек терапевтическая концентрация в моче определяется на протяжении 4-6 ч, что объясняет назначение суточной дозы (60 мг/ кг) в 4 приёма. За сутки выводится 90% препарата, при отсутствии почечной недостаточности препарат не кумулирует.
Нежелательные лекарственные реакции. Наиболее часто отмечается гепатотоксическое действие. Могут возникать диспепсии (особенно при приёме натощак), изредка аллергические реакции, гепатотоксичность, симптомы поражения ЦНС (головокружение, головная боль, повышение судорожной активности), панцитопения и гемолитическая анемия.
|
|
|
Препарат противопоказан новорождённым и детям первых месяцев жизни, а также больным с заболеваниями печени.
Фторхинолоны
Фторхинолоны обладают бактерицидным действием, инактивируя ферменты ДНК-гиразу и топоизомеразу IV, нарушая тем самым синтез ДНК микробной клетки; топоизомеразу II и IV блокирует ломефлоксацин.
Спектр активности. Фторхинолоны характеризуются значительно более широким антимикробным спектром, высокой бактерицидной активностью, хорошим распределением в органах, что позволяет применять их для лечения широкого спектра инфекций различной локализации (табл. 26-19).
Для фторхинолонов характерно действие на грамотрицательные бактерии - кишечную палочку (E. coli), шигеллы, сальмонеллы, протей (Proteus spp.), клебсиеллу (Klebsiella spp.), к ним чувствительны стафилококки (в том числе пенициллинрезистентные и некоторые метициллинрезистентные S. aureus), грамотрицательные кокки (гонококк, менингококк, М. catarrhalis), грамотрицательные бактерии семейства Enterobacteriaceae (E. coli, сальмонеллы, шигеллы, протей, энтеробактер, клебсиелла, серрация, провиденция, цитробактер, морганелла), синегнойная палочка (P. aeruginosa), а также кампилобактеры и легионеллы, M. tuberculosis.
К хинолонам II поколения малочувствительно большинство стрептококков (в том числе пневмококк), энтерококки, хламидии, микоплазмы; не действуют на спирохеты, листерии и большинство анаэробов.
Хинолоны III поколения обладают высокой активностью в отношении пневмококков, включая пенициллинрезистентные, и атипичных возбудителей (хламидии, микоплазмы).
Хинолоны IV поколения по антипневмококковой активности и действию на атипичных возбудителей превосходят хинолоны предшествовавших поколений. Обладают высокой активностью против неспорообразующих анаэробов (B. fragilis и др.).
|
|
|
Третье поколение фторхинолонов, «респираторные фторхинолоны», рекомендовано при лечении внебольничных пневмоний, что объясняется несколькими причинами.
• Респираторные фторхинолоны - препараты широкого спектра действия, потенциально активные по отношению ко всем наиболее часто встречающимся возбудителям внутрибольничных пневмоний (см. табл. 26-19): грамположительным микроорганизмам (пневмококки, стафилококки), большинству грамотрицательных и внутриклеточных возбудителей, а также микобактериям тубер- кулёза и некоторым анаэробам.
• Резистентность S. pneumoniae и других частых возбудителей внутрибольничных пневмоний к препаратам этой группы за последнее десятилетие практически не изменилась (хотя такая тенденция всё же имеет место). В то же время доля пенициллинрезистентных штаммов пневмококка в ряде стран возросла в 5-10 раз. Кроме того, пока нет оснований для прогнозирования быстрого увеличения числа микроорганизмов, невосприимчивых к действию фторхинолонов, так как возникновение устойчивости определяется мутацией сразу двух различных участков микробной ДНК, а вероятность такого события довольно низка.
• Многие респираторные фторхинолоны доступны как в формах для внутривенного введения, так и для приёма внутрь, что позволяет проводить ступенчатую терапию.
• Большинство респираторных фторхинолонов обладает выгодными фармакокинетическими особенностями, позволяющими применять эти антибактериальные препараты однократно или дважды в день.
Наряду с этим приходится констатировать, что стоимость респираторных фторхинолонов гораздо выше стоимости антибактериальных препаратов, применяемых в рутинной практике; кроме того, сохраняется запрет на использование препаратов этой группы для лечения детей и беременных.
Фармакокинетика. Фармакокинетические параметры фторхинолонов представлены в табл. 26-20.
Фторхинолоны привлекательнее хинолонов с фармакокинетической точки зрения:
• прекрасно всасываются при приёме внутрь (биодоступность 90%), пища не влияет на полноту всасывания, создают высокие плазменные концентрации;
|
|
|
• хорошо проникают практически во все органы и ткани (плохая проницаемость через ГЭБ): лёгкие, почки, кости, простату;
• имеют длительный период полувыведения, могут назначаться 1-2 раза в сутки.
Таблица 26-20. Фармакокинетические параметры хинолонов при приёме внутрь
 Таблица 26-21. Фармакокинетика фторхинолонов
Таблица 26-21. Фармакокинетика фторхинолонов
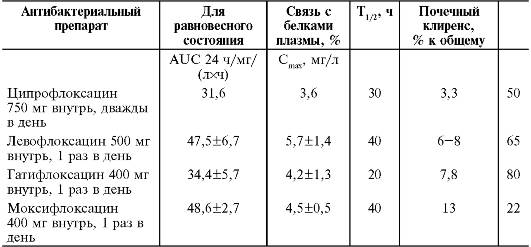 AUC - площадь под кривой «концентрация/время». Сmах - максимальная концентрация в плазме крови.
AUC - площадь под кривой «концентрация/время». Сmах - максимальная концентрация в плазме крови.
Метаболизм. Степень метаболизма препаратов данной группы в печени зависит от вида препарата: наиболее активно метаболизируются в печени налидиксовая, оксолиновая кислота, пефлоксацин, наименее - пипемидовая кислота, офлоксацин и ломефлоксацин. Препараты группы фторхинолонов ингибируют цитохром P-1A2, осуществляющим деалкилирование теофиллина, и способны уже через сутки совместного применения повышать концентрацию эуфиллина.
По силе влияния на фармакокинетику теофиллина фторхинолоны подразделяют на три группы:
I группа - препараты с выраженным влиянием на фармакокинетику теофиллина и с высоким риском развития побочного эффекта: через сутки после начала приёма возможно повышение концентрации теофиллина на 50-65% с развитием симптомов его передозировки и даже интоксикации им;
II группа - препараты, вызывающие умеренное повышение содержания теофиллина в плазме (до 40%): ципрофлоксацин (25-30%), пефлоксацин, норфлоксацин (10-15%);
III группа - препараты, не взаимодействующие с теофиллином на уровне метаболизма: офлоксацин, ломефлоксацин, спарфлоксацин.
Распределение. Хинолоны I поколения не создают терапевтических концентраций в крови, многих органах и тканях, создавая при этом терапевтически значимые концентрации в моче.
Фторхинолоны характеризуются большим объёмом распределения, создают высокие концентрации во многих органах и тканях. Все эти препараты примерно одинаково хорошо поступают в ткань лёг- кого. Более высокие концетрации фторхинолонов (при одной и той же дозировке) достигаются при внутривенном введении. Фторхинолоны накапливаются в слизистой оболочке бронхов примерно в той же концентрации, что и в плазме, чего нельзя сказать ни об одном из β-лактамных препаратов (их концентрация в ткани лёгкого всегда меньше, чем в крови). Концентрация фторхинолонов в эпителиальной жидкости очень высока. Фторхинолоны обладают способностью попадать внутрь клеток, но внутриклеточная среда более кислая, что приводит к усилению ионизации вещества, поэтому наблюдается обратный ток препарата (из клеток наружу). Однако в целом у препаратов этой группы внутриклеточные концентрации превышают внеклеточные, что объясняет доказанную в клинических исследованиях эффективность пефлоксацина и ципрофлоксацина при пневмонии, вызываемой Legionella pneumophila.
|
|
|
Ципрофлоксацин, офлоксацин и пефлоксацин проникают через
ГЭБ.
Выведение. Выводятся из организма преимущественно почками, частично с жёлчью. При нарушении функции почек выведение препаратов замедляется, особенно офлоксацина и ломефлоксацина. При тяжёлой почечной недостаточности необходима коррекция доз всех фторхинолонов. При проведении гемодиализа фторхинолоны удаляются из крови в незначительных количествах (10-30%).
Нежелательные лекарственные реакции
Для хинолонов в большей степени характерны диспептические расстройства, цитопении, гемолитическая анемия, возбуждение ЦНС (понижение судорожного порога), гепатотоксичность. Для фторхинолонов - торможение развития хрящевой ткани (поэтому противопоказаны беременным и кормящим матерям; у детей могут применяться только по особым показаниям), в редких случаях возможно развитие тендинитов (воспаление сухожилий, особенно ахилловых), удлинение интервала Q-T на электрокардиограмме (что может провоцировать развитие желудочковых аритмий), фотодерматозы, возбуждение ЦНС (в редких случаях вызывают судороги, психозы, галлюцинации). Более детальные сведения приведены в табл. 26-22.
Не следует назначать фторхинолоны больным с судорожным синдромом и выраженной цереброваскулярной недостаточностью. Изредка возможны артралгии, миалгии, аллергические кожные реакции (сыпь), лейкопения, эозинофилия, транзиторная гиперферментемия. Нефротоксического эффекта не отмечено.
Таблица 26-22. Сравнительная оценка нежелательных лекарственных реакций фторхинолонов (%)
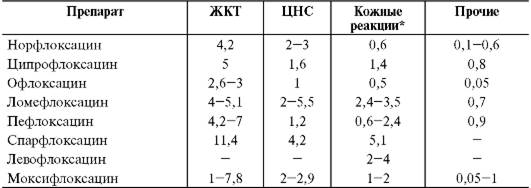 * Включая фототоксичность. По сводным данным, охватывающим 1040 больных.
* Включая фототоксичность. По сводным данным, охватывающим 1040 больных.
Лекарственное взаимодействие
Хинолоны I поколения не следует сочетать с нитрофуранами, так как резко снижается эффект препаратов; синергизм отмечается при взаимодействии с хлорамфениколом, тетрациклинами, полиеновыми антибиотиками. Всасывание фторхинолонов ухудшается при одновременном приёме антацидов; препаратов, содержащих кальций или алюминий, препаратов железа, сукральфата. β-Лактамные антибиотики, аминогликозиды, цефалоспорины, макролиды можно применять в комбинации с хинолонами (целесообразен контроль функции печени и назначение гепатопротекторов). Установлен синергизм пенициллинов и хинолонов в отношении синегнойной палочки.
|
|
|
Циметидин, ранитидин, метронидазол, клиндамицин, глибенкламид не взаимодействуют с ципрофлоксацином. Фторхинолоны (особенно ципрофлоксацин, норфлокацин и пефлоксацин) могут ингибировать метаболизм теофиллина в печени и повышать его концентрацию в крови. При сочетании с НПВС возрастает риск нейротоксичности, вплоть до развития судорог. Совместное назначение урикозурических препаратов (пробенецид) замедляет выведение фторхинолонов и повышает его плазменную концентрацию. Рифампицин увеличивает CL ципрофлоксацина, их совместное применение может ослаблять антибактериальное действие, хотя эти положения требуют дальнейшего изучения (при туберкулёзе не доказано). Эффект варфарина может усиливаться при приёме ципрофлоксацина, но в меньшей степени, чем при приёме других хинолонов. В сочетании с алкоголем ципрофлоксацин снижает способность к концентрации внимания.
Важнейшие, клинически значимые взаимодействия фторхинолонов представлены в табл. 26-23.
Таблица 26-23. Важнейшие взаимодествия фторхинолонов
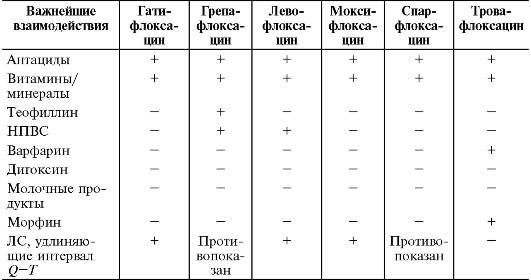 Показания
Показания
Инфекции нижних дыхательных путей (обострение хронического
бронхита, нозокомиальная пневмония). Инфекции желчевыводящих путей. Инфекции мочевыводящих путей. Простатит.
Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
Кишечные инфекции (шигеллёз, сальмонеллёз).
Тяжёлые инфекции кожи, мягких тканей, костей, суставов.
Гонорея.
Туберкулёз (ципрофлоксацин, офлоксацин и ломефлоксацин). Противопоказания
Для всех хинолонов - аллергические реакции на препараты группы хинолонов и беременность. Дополнительно для фторхинолонов I поколения - тяжёлые нарушения функций печени и почек, тяжё- лый церебральный атеросклероз. Дополнительно для фторхинолонов II-IV поколения - детский возраст, кормление грудным молоком.
Предостережения
Применение фторхинолонов у детей до 15-18 лет ограничено ввиду возможного повреждения костно-суставной системы. В последнее время это ограничение оспаривается, хотя фармакологические руководства развитых стран подчёркивают, что безопасность ципрофлоксацина для лиц моложе 18 лет не доказана. Однако не исключается возможность их назначения по жизненным показаниям.
Ципрофлоксацин противопоказан лицам старческого возраста, а также больным, страдающим эпилепсией и поражениями ЦНС. У пожилых пациентов увеличивается риск разрывов сухожилий, особенно при одновременном приёме глюкокортикоидов.
Нитрофураны
Нитрофураны оказывают преимущественно бактериостатический эффект, устойчивость к ним развивается медленно. Спектр антимикробного действия довольно широк: нитрофураны подавляют грамположительные (стрептококки, пенициллиназопродуцирующие стафилококки), грамотрицательные микроорганизмы (кишечные палочки, сальмонеллы, шигеллы, клебсиеллы, энтеробактеры) и многие простейшие (лямблии, трихомонады). Антимикробное действие не снижается в присутствии гноя и других продуктов тканевого распада. По спектру действия, фармакокинетическим характеристикам представители этой группы препаратов существенно отличаются друг от друга.
Нитрофурал (фурацилин*) в связи с производством более безопасных и эффективных нитрофуранов применяется только местно (полоскание зева, промывание раневых поверхностей, при лечении гнойных ран), в настоящее время к нему устойчивы возбудители многих внутрибольничных инфекций.
Нитрофурантоин (фурадонин*) хорошо всасывается, его используют только при инфекциях мочевыводящих путей, что обусловлено осо-
бенностями его фармакокинетики: он чрезвычайно быстро выводится почками (Т1/2 составляет 20-60 мин) и в крови и тканях не создаётся средней терапевтической концентрации. Антимикробный эффект усиливается в щелочной моче. Нитрофурантоин значительно токсичнее других нитрофуранов, назначаемых внутрь. Вероятность токсических эффектов препарата повышается при нарушении выделительной функции почек (при снижении CL креатинина ниже 40 мл/мин препарат не назначают) и при сочетании с подкисляющими мочу препаратами.
Фуралтадон (фуразолин*) по спектру антимикробной активности мало отличается от фуразолидона, лучше всасывается, менее активен по отношению к простейшим. Средняя терапевтическая концентрация после приёма разовой дозы удерживается в течение 4-6 ч. При кислой реакции мочи усиливается реабсорбция препарата, что может привести к кумуляции. При низких значениях рН и олигурии препарат отменяют.
Нифурател (макмирор*) оказывает противопротозойное, противогрибковое действие. Обладает широким спектром антимикробного действия, активен в отношении Trichomonas vaginalis, высокоактивен в отношении рода Candida. Применяется для лечения вульвовагинальных инфекций, инфекционно-воспалительных заболеваний мочевыводящих путей, кишечного амёбиаза и лямблиоза. Возможны аллергические реакции и диспепсические явления. Противопоказан при беременности и лактации.
Нифуроксазид (эрсефурил*) - противомикробное средство широкого спектра действия (грамположительные возбудители: стафилококки, стрептококки, гемофильная палочка; грамотрицательные микроорганизмы: сальмонеллы, энтеробактер). Кишечная палочка, протей. Не нарушает равновесия кишечной микрофлоры. Имеет низкую абсорбцию, поэтому применяется при диарее инфекционного генеза. Противопоказано применение при гиперчувствительности к препарату и нитрофуранам, у новорождённых.
Фуразидин (фурагин*). Основная особенность фармакокинетики - относительно медленное выведение, поэтому может назначаться два раза в сутки; в моче отмечаются более низкие концентрации препарата, чем на фоне нитрофурантоина.
Растворимый фуразидин применяется внутривенно капельно, введение суточной дозы (0,1% водный раствор) обеспечивает среднюю терапевтическую концентрацию в крови и тканях в течение 48 ч.
Фуразолидон подавляет развитие трихомонад и лямблий, грамположительных и грамотрицательных микроорганизмов. Блокирует МАО. Назначают внутрь (после еды). Всасывается хуже, чем нитрофурантоин и фурагин*, терапевтическая концентрация его сохраняется в кро-
ви 4-6 ч. В терапевтических концентрациях обнаруживается в жёлчи, моче. Выделяясь с жёлчью, оказывает хороший эффект при кишечных инфекциях. Особенно активен по отношению к возбудителям дизентерии, брюшного тифа и паратифов, лямблиозе. Основной путь элиминации - почечная экскреция. Кумулирует в крови при выраженных нарушениях клубочковой фильтрации.
Лекарственные взаимодействия
Опасно сочетание нитрофуранов с кислыми препаратами (витамин С, кальция хлорид, аммония хлорид).
В связи со способностью фуразолидона ингибировать МАО противопоказано сочетание его с другими препаратами, ингибирующими этот фермент (ниаламид и др.), сочетание фуразолидона с этими препаратами может вызвать артериальную гипертензию за счёт увеличения активности эндогенных катехоламинов.
Нежелательные лекарственные реакции
Диапазон между терапевтическими и токсическими дозами нитрофуранов довольно велик. Побочные реакции при использовании фуразолидона, фурагина*, фуразолина* встречаются реже и примерно с одинаковой частотой. Значительно возрастает вероятность токсических осложнений у новорождённых и при почечной недостаточности.
Наиболее часто встречаются диспепсические расстройства (тошнота, рвота, боль в животе), которые особенно характерны для нитрофурантоина. Для профилактики диспепсических расстройств нитрофураны принимают после еды, запивают щелочными растворами. Значительно реже встречаются неврологические (моно- и полиневриты) и гематологические (гемолитическая и мегалобластная анемии) осложнения, поражение кожи (лейкодерма) и бронхолёгочные проявления побочного действия (отёк лёгких, бронхоспазм, пневмонит у женщин старше 60 лет, сопровождающийся лихорадкой и эозинофилией). У новорождённых и грудных детей возможно образование метгемоглобина. Аллергические реакции при использовании нитрофуранов встречаются редко, в основном ограничиваются поражением кожи.
Весьма специфическим свойством нитрофуранов, имеющим практическое значение, является их способность снижать толерантность к алкоголю (антабусоподобный эффект). Эффект сохраняется в течение 5-7 дней после отмены нитрофуранов.
Оксихинолины
Нитроксолин. Бактерицидное действие препарата реализуется путём комплексирования их с ионами металлов, необходимых для актива-
ции ферментных систем микроорганизмов. Действует бактерицидно. Селективно ингибирут синтез бактериальной ДНК. Спектр действия включает грамотрицательные бактерии, амёбы, грибы рода Candida.
Нитроксолин хорошо всасывается в ЖКТ. Очень быстро выводится почками, что обусловливает низкую плазменную концентрацию (при сохранённой функции почек). Показанием к назначению нитроксолина являются инфекции мочевыводящих путей, вызванные грамотрицательной микрофлорой. Нитроксолин можно сочетать с противогрибковыми антибиотиками и сульфаниламидами. Не используют у новорождённых и больных со сниженной функцией почек.
Применяется для лечения дизентерии, сальмонеллёза, пищевых токсикоинфекций, вызванных стафилококками и энтеробактериями, энтероколите, дисбактериозе; вагините, трихомониазе.
Нитроимидазолы
Группа нитроимидазолов представлена следующими синтетическими препаратами: метронидазолом, тинидазолом, орнидазолом.
Фармакодинамика
Нитроимидазолы избирательно воздействуют на микроорганизмы, ферментные системы которых способны восстанавливать нитрогруппу. Активные восстановленные формы препаратов нарушают репликацию ДНК и синтез белка в микробной клетке, ингибируют тканевое дыхание.
Спектр активности
Препараты обладают высокой активностью в отношении анаэробных бактерий и простейших. К нитроимидазолам чувствительны T. vaginalis, E. histolytica, G. lamblia, L. intestinalis, B. coli, Leishmania spp., а также H. pylori.
Фармакокинетика
Хорошо всасываются при приёме внутрь. Биодоступность метронидазола более 80%, орнидазола - 90%, тинидазола - 100% и не зависит от приёма пищи. После ректального введения метронидазола в свечах биодоступность на 10% ниже, чем при приёме внутрь.
Метронидазол. При внутривенном введении 500 мг в течение 20 мин максимальная концентрация в сыворотке крови через 1 ч составляет 35,2 мкг/мл, через 4 ч - 33,9 мкг/мл, через 8 ч - 25,7 мкг/мл. Время достижения максимальной концентрации - 30-60 мин, минимальная концентрация при последующем введении 18 мкг/мл. Максимальная концентрация определяется через 1 ч после прекращения введения
и поддерживается на терапевтическом уровне в крови 6-8 ч. Объём распределения у взрослых 0,54-0,81 л/кг. Связь с белком плазмы 10-
20%.
Тинидазол. Максимальная концентрация после приёма наблюдается через 2 ч, составляет 40-50 мкг/мл, через 24 ч - 11-19 мкг/мл, через 72 ч - 1 мкг/мл, объём распределения 50 л, связь с белком -
12%.
Орнидазол. Время достижения максимальной концентрации - 1- 2 ч, связь с белками плазмы не менее 15%.
Метаболизм
Нитроимидазолы метаболизируются в печени с образованием активных и неактивных метаболитов (метронидазол метаболизируется на 30-60% с образованием активного метаболита 2-оксиметронидазо- ла, оказывающего противопротозойное и антимикробное действие).
Распределение
Хорошо распределяются, проникают в ткани, абсцессы, через ГЭБ, плаценту; проникают в грудное молоко, выделяются со слюной и желудочным соком.
Выведение
Метронидазол. Т1/2 - 8-12 ч, при алкогольном поражении печени - 10-29 ч. Выводятся из организма почками 60-80% принятой дозы, примерно 20% в неизменённом виде; экскреция с жёлчью 50%, причём концентрация препарата в жёлчи может превышать концентрацию в крови, в кишечнике вновь всасывается; при дефекации выводится до 6-15%. При повторных введениях возможна кумуляция. При выраженной почечной недостаточности (CL креатинина <10 мл/мин) суточная доза должна быть уменьшена вдвое. Метронидазол и основные метаболиты быстро удаляются из крови при гемодиализе (Т1/2 сокращается до 2,6 ч).
Тинидазол. Т1/2 - 12-14 ч. Выделяется с грудным молоком в течение 72 ч после приёма. Экскреция с жёлчью 50%, почками 25%, в неизменённом виде 12%, в виде метаболитов за счёт обратного всасывания в почечных канальцах, с калом.
Орнидазол. Т1/2 - около 13 ч. Экскреция в виде метаболитов с мочой 60-70%, калом 20-25%, около 5% выводится в неизменённом виде.
Нежелательные лекарственные реакции
Нежелательные лекарственные реакции представлены в табл. 26-25.
Таблица 26-25. Нежелательные лекарственные реакции нитроимидазолов
 Показания к применению
Показания к применению
• Анаэробные или смешанные аэробно-анаэробные инфекции различной локализации:
- кожи, мягких тканей, костей, суставов;
- верхних и нижних дыхательных путей (синусит, аспирационная пневмония, эмпиема, абсцесс лёгкого);
- ЦНС (менингит, абсцесс мозга);
- интраабдоминальные, включая инфекции органов малого таза;
- псевдомембранозный колит;
- периоперационная профилактика при интраабдоминальных и гинекологических вмешательствах.
• Протозойные инфекции: трихомониаз, лямблиоз, балантидиаз, амёбная дизентерия и внекишечный амёбиаз (амёбный гепатит, абсцесс печени, мозга).
• Эрадикация H. pylori при язвенной болезни.
Противопоказания
• Повышенная чувствительность к нитроимидазолам.
• Органические заболевания ЦНС с выраженными клиническими проявлениями.
• I триместр беременности.
Применение нитроимидазолов в период грудного вскармливания не рекомендуется, так как концентрации метронидазола и его метаболитов в плазме крови ребёнка составляют 10-20% от концентраций в крови матери.
Лекарственные взаимодействия
Лекарственные взаимодействия нитроимидазолов приведены в табл. 26-26.
Таблица 26-26. Лекарственные взаимодействия нитроимидазолов
 ЧУВСТВИТЕЛЬНОСТЬ И РЕЗИСТЕНТНОСТЬ МИКРООРГАНИЗМОВ К АНТИБАКТЕРИАЛЬНЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВАМ
ЧУВСТВИТЕЛЬНОСТЬ И РЕЗИСТЕНТНОСТЬ МИКРООРГАНИЗМОВ К АНТИБАКТЕРИАЛЬНЫМ ЛЕКАРСТВЕННЫМ СРЕДСТВАМ
Чувствительность возбудителя характеризуется минимальной концентрацией антибиотика в питательной среде, подавляющей рост микроорганизмов. Оценка противомикробной активности проводится in vitro.
Минимальная подавляющая концентрация - наименьшая концентрация противомикробного препарата, которая через определённый период времени приостанавливает рост специфических микроорганизмов in vitro. Результаты определения чувствительности анализируются по отдельным видам микроорганизмов и их штаммов. Данные представляют как концентрацию препарата, необходимую для подавления 50% штаммов, так и концентрацию, необходимую для подавления 90% штаммов.
Минимальная бактерицидная концентрация - наименьшая концентрация противомикрообного препарата, вызывающая гибель посеянных на питательную среду микроорганизмов через определённый период времени.
Постантибиотический эффект определяют как промежуток времени между снижением концентрации препарата ниже минимальной подавляющей концентрации и возобновлением логарифмического роста микробной популяции. Постантибиотический эффект рассчитывают как разницу между временем, необходимым микроорганизмам, подвергшимся и не подвергшимся (контрольная группа) действию лекарственного вещества, чтобы их количество увеличилось в 10 раз по сравнению с количеством сразу после отмены ЛС. Оценивается в минутах и часах.
По степени чувствительности к антибактериальным препаратам бактерии разделяют на чувствительные, умеренно чувствительные и резистентные. Чувствительными считаются микроорганизмы, рост и размножение которых в очагах инфекции (крови) прекращается при средних терапевтических концентрациях лекарства в сыворотке крови (после назначения обычных доз); умеренно чувствительными - микроорганизмы, - для угнетения роста которых требуются максимальные дозы лекарственного препарата; у устойчивых (резистентные) бактериостатический эффект может быть достигнут только in vitro при высоких концентрациях лекарственного препарата, являющихся токсичными для человека.
Резистентность определяют как появление субпопуляции микроорганизмов, для которых минимальная подавляющая концентрация выше, чем для исходного штамма. Антибиотикорезистентность является неизбежным биологическим явлением, предотвратить её практически невозможно.
Антибиотикорезистентные микроорганизмы представляют опасность не только для пациента, у которого они были выделены, но и для многих других людей, даже разделённых временем и пространством, в связи с чем борьба с антибиотикорезистентностью приобрела глобальные масштабы. Клиническое значение сниженной чувствительности микроорганизмов in vitro зависит от того, превышает ли минимальная подавляющая коцентрация для этой субпопуляции те концентрации противомикробного препарата, которые могут быть достигнуты в крови, тканях или биологических жидкостях при назначении обычных доз ЛС.
Виды резистентности:
• природная - генетически обусловленное отсутствие чувствительности микроорганизма к противомикробным средствам (напри-
мер, устойчивость вирусов к антибиоткам, грамотрицательных бактерий к бензилпенициллину, анаэробных бактерий к цефалоспоринам I поколения и др.);
• приобретённая - устойчивость возникает в результате мутации отдельных штаммов бактерий и селекции устойчивых клонов микроорганизмов либо в результате внехромосомного (плазмидного) обмена генетической информацией между отдельными бактериальными клетками.
Выделяют два типа приобретённой резистентности бактерий.
• Первичная резистентность - устойчивость микроорганизма до начала лечения; определяет выбор антибактериального препарата (например, первичная устойчивость некоторых штаммов пневмококка или золотистого стафилококка к бензилпенициллину делает бессмысленным его назначение).
• Вторичная резистентность бактерий возникает или возрастает в процессе лечения антибактериальными препаратами и требует пересмотра тактики лечения.
Резистентность микроорганизмов имеет строго специфический характер в отношении отдельных антибактериальных препаратов или нескольких препаратов в пределах одной группы. Полная перекрёст- ная резистентность наблюдается среди устойчивых к природным тетрациклинам, частичная - среди устойчивых к макролидам микробов.
|
|
|


