 |
Е.Г. Коробейникова, Н.Ю. Кожевникова, Г.Б. Свидзинская
|
|
|
|
ХИМИЯ
Методические рекомендации
по изучению дисциплины
слушателями заочной формы обучения
Специальность 280705.65 «Пожарная безопасность»
Санкт-Петербург - 2012
Рецензенты:
И.Д. Чешко, доктор технических наук, профессор
(СПб филиал ВНИИПО МЧС России);
Е.В. Любимов, кандидат технических наук, доцент
(СПб университет ГПС МЧС России)
Е.Г. Коробейникова, Н.Ю. Кожевникова, Г.Б. Свидзинская
Химия: Методические рекомендации по изучению дисциплины слушателями заочной формы обучения по специальности 280705.65 - «Пожарная безопасность». / Под ред. В.С. Артамонова. - СПб.: Санкт-Петербургский университет ГПС МЧС России, 2012. – 26 с.
Пособие предназначено для слушателей заочного обучения и включает указания по изучению раздела I "Введение в общую химию", раздела II "Основные закономерности протекания химических процессов" и раздела III "Химия растворов. Дисперсные системы. Начала электрохимии". Для каждой темы приводится список необходимой литературы и примеры решения расчетных задач. Для самостоятельной работы в приложении даны справочные таблицы.
ã Санкт-Петербургский университет
ГПС МЧС России, 2012
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
(задачи №№ 1 – 25).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
При изучении темы 1 необходимо обратить внимание на следующие вопросы.
|
|
|
Химия как раздел естествознания. Место химии в системе наук и среди специальных дисциплин в пожарном деле.
Химия как наука о веществах и их превращениях. Основные исторические вехи развития химической науки и технологии.
Необходимо знать и уметь использовать для практических расчетов основные понятия и законы химии: закон сохранения массы веществ, закон постоянства состава, закон объемных отношений, закон Авогадро и его следствия. Различать понятия "молекула, атом, химический элемент, простые и сложные вещества, аллотропия, относительные атомные и молекулярные массы, молярная масса, валентность".
Пример 1.1. Сколько молекул содержится в 1 литре жидкой воды и в 1 литре паров воды при нормальных условиях? Вычислить массу молекулы воды.
Решение:
Для решения этой задачи следует воспользоваться формулами для расчета числа молей (n) вещества.
(1) 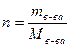 ; (2)
; (2)  ; (3)
; (3)  , где
, где
Мв-ва – молярная масса вещества, г/моль или кг/кмоль;
VМ – молярный объем газа (пара) при заданных условиях, л/моль или м3/кмоль;
Nч-ц – число частиц в образце вещества;
NА ц – число Авогадро, 1/моль.
1. Масса 1 литра воды составляет 1 кг или 1000 г. Молярная масса воды Н2О составляет 18 г/моль. Вычислим число молей молекул воды в этом образце по формуле (1).
 моль.
моль.
Зная число молей воды, для вычисления числа молекул воды в этом образце воспользуемся формулой (3):
Nч-ц = 55,6 × 6,02×1023 = 3,34×1025 молекул
2. При нормальных условиях 1 моль любого газа (пара) занимает объем 22,4 л. Вычислим, сколько молей воды содержится в образце объемом 1 л. Для этого воспользуемся формулой (2):
 моль.
моль.
Число молекул воды в этом образце составит
Nч-ц = 0,045 × 6,02×1023 = 2,7×1022 молекул.
3. Масса молекулы воды может быть рассчитана из следующего соотношения:
Мв-ва = mмолекулы × NА = mмолекулы × 6,02×1023.
Молярная масса воды составляет 18 г/моль. Тогда масса одной молекулы составит
|
|
|
mмолекулы=  г = 2,99×10-26 кг.
г = 2,99×10-26 кг.
2. РАСЧЕТЫ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
(задачи №№ 26 – 50).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Наиболее важными для дальнейшего усвоения химии и смежных дисциплин являются умение грамотно записывать уравнения реакций горения различных веществ в кислороде и в воздухе; рассчитывать концентрационные пределы распространения пламени; решать "задачи на горение" (расчет массы и объема сгоревшего вещества; расчет объема воздуха, затраченного на горение; расчет объема и массы образовавшихся продуктов горения).
Пример 2.1. Какой объем этана С2Н6 сгорел, если в результате образовалось 3 кг паров воды? Температура 200С, давление 98 кПа.
Решение:
1. Составляем уравнение реакции горения этана в воздухе.
Х м3 3 кг
С2Н6 + 3,5(О2 + 3,76 N2) = 2СО2 + 3Н2О + 3,5 × 3,76 N2
VМ = 3× М =
= 24,9 м3 = 3×18 кг
2. В соответствии с условием задачи в уравнении реакции над формулами веществ записываем неизвестные и известные величины с указанием размерности.
Под формулами веществ записываем
- молярную массу (М кг/кмоль) соответствующего вещества (в том случае, если дана масса или надо определить массу в кг) или
- молярный объем (VМ м3/кмоль) вещества, находящегося в газовой фазе (в том случае, если дан объем или надо определить объем в м3).
Стехиометрические коэффициенты, стоящие в уравнении реакции и обозначающие число кмоль веществ, вступивших в реакцию или образовавшихся в результате реакции, необходимо учитывать, умножая М или VМ на соответствующий стехиометрический коэффициент.
Молярная масса воды VМ = 18 кг/кмоль. В данной задаче стехиометрический коэффициент перед Н2О равен 3, поэтому под формулой воды следует написать 3× М = 3×18 кг.
При нормальных условиях объем любого газа (пара) равен V0 = 22,4 м3/кмоль.
Нормальными условиями считаются: температура Т0 = 273 К (00С);
давление Р0 = 760 мм рт.ст. = 1 атм = 105 Па = = 0,1 МПа = 101,3 кПа
|
|
|
Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
 , где
, где
Р и Т – данные в задаче температура и давление.
Для нашей задачи рассчитываем молярный объем при заданных условиях:  м3/кмоль.
м3/кмоль.
Размерность Р0 должна соответствовать размерности давления, приведенного в условии задачи.
Найденное значение VМ подставляем под формулой этана (стехиометрический коэффициент перед горючим веществом всегда должен быть равен 1!).
3. Определим объем сгоревшего этана. Согласно уравнению реакции можно составить следующую пропорцию:
24,9 м3 С2Н6 соответствуют 3×18 кг Н2О
Х м3 С2Н6 соответствуют 3 кг Н2О.
Отсюда
 м3.
м3.
Ответ: сгорело 1,38 м3 этана.
Пример 2.2. Какая концентрация углекислого газа (в объемных %) образовалась в помещении объемом 500 м3, если сгорело 5 кг ацетона СН3СОСН3? Температура –50С, давление 750 мм рт.ст.
Решение:
1. Составляем уравнение реакции горения ацетона в воздухе:
5 кг Х м3
СН3СОСН3 + 4(О2 + 3,76 N2) = 3СО2 + 3Н2О + 4 × 3,76 N2
М = 58 кг 3× VМ =
= 3×22,3 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса ацетона 58 кг/кмоль. Записываем эту величину под формулой ацетона.
4. Рассчитаем, какой объем занимает 1 кмоль углекислого газа (как и любого другого газообразного вещества) при данных температуре и давлении.
 м3/кмоль.
м3/кмоль.
Записываем данную величину под формулой углекислого газа, умножив ее на стехиометрический коэффициент 3.
5. По уравнению реакции найдем объем углекислого газа, образовавшегося в результате сгорания ацетона:
 м3.
м3.
6. Рассчитаем объемную концентрацию углекислого газа в помещении:
 %.
%.
Ответ: объемная концентрация углекислого газа составила 1,16 %.
3. ПЕРИОДИЧЕСКИЙ ЗАКОН И СТРОЕНИЕ АТОМА
(задачи №№ 51 – 75).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
|
|
|
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Данная тема предполагает изучение величайшего открытия 20 столетия -периодического закона и Периодической системы Д.И. Менделеева. Рассматривая историю открытия Д.И. Менделеевым периодического закона, следует рассмотреть достижения химической науки к середине 19 века, предпосылки и условия открытия.
Сравните первоначальную и современную формулировку периодического закона и понятия периодичности.
Структура таблицы периодической системы элементов. Характеристика элемента и его соединений, оценка их пожароопасных свойств по положению в Периодической системе.
Используя знания из курса физики и химии, рассмотрите развитие основных представлений о строении атома, современные квантово-механические представления о строении атома, характеристику энергетического состояния электрона квантовыми числами.
Электронная структура атомов. Необходимо уметь написать электронный паспорт элемента и дать характеристику его электронной структуры.
4. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ЭЛЕМЕНТОВ
ГЛАВНЫХ ПОДГРУПП
(задачи №№ 76 – 100).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
При изучении данной темы необходимо самостоятельно вспомнить и обобщить материал курса химии средней школы: «простые вещества и химические соединения, металлы и неметаллы, оксиды, гидроксиды, кислоты, соли. Классификация, получение, химические свойства. Генетическая связь между классами неорганических соединений». Особое внимание при работе над материалом данной темы следует обратить на пожароопасные свойств элементов главных подгрупп Периодической системы элементов Д.И. Менделеева и их соединений, а также использование химических соединений (антипиренов) для огнезащиты горючих веществ и материалов.
5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
(задачи №№ 101 – 125).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
|
|
|
3. Коробейникова Е.Г., Кожевникова Н.Ю., Свидзинская Г.Б. Электрохимические процессы. Учебное пособие. - СПб.: СПбИПБ МВД РФ, 1998, 61 с.
Тема предполагает изучение следующих основных вопросов.
Сущность окислительно-восстановительных реакций. Степень окисления и валентность. Методика составления окислительно-восстановительных реакций на основе электронного баланса.
Важнейшие окислители и восстановители и их место в Периодической системе элементов. Пожароопасные свойства окислителей и восстановителей.
Пример 5.1. Методом электронного баланса подберите коэффициенты в схеме окислительно-восстановительной реакции взаимодействия магния с концентрированной азотной кислотой.
Укажите окислитель и восстановитель.
Mg + HNO3 = Mg(NO3)2 + NH4NO3 + H2O
Решение:
1. Определяем степени окисления элементов, входящих в уравнение, и находим элементы, которые изменяют степень окисления в ходе реакции:
0 +5 +2 +5 -3 +5
Mg + HNO3 = Mg(NO3)2 + NH4NO3 + H2O
Обратите внимание, что азот в степени окисления (+5) встречается в уравнении 3 раза.
2. Составляем уравнения электронного баланса:
восстановитель Mg0 - 2 e— = Mg+2(реакция окисления) ê 4
окислитель N+5 + 8 e— = N-3 (реакция восстановления) ê 1
3. Полученный коэффициент 4 при восстановителе Mg0 и продукте его окисления Mg+2 можно переносить в уравнение реакции, т.к. элементы в данной степени окисления встречаются в уравнении только 1 раз.
Коэффициент 1 может быть поставлен и перед N-3 (NH4NO3), поскольку азот в степени окисления (-3) также лишь один раз встречается в уравнении.
Для всех остальных элементов (в том числе и для N+5) коэффициенты подбираем.
4 Mg + HNO3 = 4 Mg(NO3)2 + NH4NO3 + H2O
1. Металлы (Mg) у нас уравнены.
2. Уравниваем неметаллы (азот).
В правой части уравнения 8 + 2 = 10 атомов азота, следовательно, перед формулой азотной кислоты HNO3 в левой части уравнения необходимо поставить коэффициент 10:
4 Mg + 10 HNO3 = 4 Mg(NO3)2 + NH4NO3 + H2O
3. Уравниваем водород.
В левой части уравнения 10 атомов водорода. В правой части уравнения в молекуле нитрата аммония NH4NO3 уже есть 4 атома водорода, поэтому перед формулой воды H2O в правой части уравнения поставим коэффициент 3.
4 Mg + 10 HNO3 = 4 Mg(NO3)2 + NH4NO3 + 3 H2O
4. Проводим проверку правильности подбора коэффициентов по кислороду.
В левой части уравнения 30 атомов кислорода. В правой также 24 + 3 + 3 = 30. Следовательно, уравнение написано правильно.
6. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
(задачи №№ 126 – 150).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Для выполнения заданий можно воспользоваться данными таблицы 1 приложения.
При изучении темы основными вопросами являются следующие.
Предмет химической термодинамики. Понятие термодинамической системы. Параметры состояния и термодинамические функции состояния. Первый закон термодинамики. Внутренняя энергия и энтальпия. Закон Гесса и следствия из него. Теплоты образования и горения вещества. Термохимические расчеты, их использование в пожарно-технических расчетах. Оценка пожарной опасности веществ по теплотам образования.
Пример 6.1. Каков тепловой эффект реакции образования 44 г этилацетата СН3СООС2Н5, если его энтальпия горения равна
DНгор = - 2256,3 кДж/моль?
Решение:
1. Решение этой задачи предполагает вначале расчет энтальпии образования 1 моль этилацетата. Для этого запишем уравнение реакции горения этилацетата в кислороде:
СН3СООС2Н5 + 5О2 = 4СО2 + 4Н2О
По 1-му следствию закона Гесса тепловой эффект этой реакции DН0р-и
может быть записан следующим образом:
DН0р-и = 4DН0(СО2) + 4DН0(Н2О) - DН0(СН3СООС2Н5). (1)
DН0(СО2), DН0(Н2О), DН0(СН3СООС2Н5) – энтальпии образования веществ.
Для воды и углекислого газа энтальпии образования известны и их можно найти в таблице 1 приложения. По условию задачи энтальпию образования этилацетата необходимо рассчитать.
По 2-му следствию закона Гесса тепловой эффект этой же реакции равен энтальпии горения этилацетата.
DН0р-и = DН0 гор (СН3СООС2Н5). (2)
По условию задачи величина DН0 гор (СН3СООС2Н5) известна. Объединив уравнения (1) и (2) можно записать:
DН0 гор (СН3СООС2Н5) = 4DН0(СО2) + 4DН0(Н2О) - DН0(СН3СООС2Н5).
Тогда энтальпия образования этилацетата DН0(СН3СООС2Н5) может быть рассчитана следующим образом:
DН0(СН3СООС2Н5) = 4DН0(СО2) + 4DН0(Н2О) -DН0 гор (СН3СООС2Н5)=
= 4×(–393,5) + 4×(–241,8) – (- 2256,3) = - 463,2 кДж/моль.
Полученная величина означает, что при образовании 1 моль этилацетата выделяется 463,2 кДж тепла (DН<0).
2. Вычислим тепловой эффект образования 44 г этилацетата.
Молярная масса (масса 1 моля) СН3СООС2Н5 составляет 88 г/моль.
Определим число молей этилацетата:
n = 44/88 = 0,5 моль.
Зная тепловой эффект реакции образования 1 моля вещества и число молей этого вещества, рассчитаем тепловой эффект:
DН = 0,5 × (- 463,2) = - 231,6 кДж
Ответ: при образовании 44 г этилацетата выделяется 231,6 кДж тепла.
|
|
|


