 |
Расчеты с использованием термодинамических
|
|
|
|
ФУНКЦИЙ СОСТОЯНИЯ
(задачи №№ 151 – 175).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Второй закон термодинамики. Возможность и направление протекания химических процессов. Обратимые химические процессы и химическое равновесие. Энтропия как мера неупорядоченности системы. Изменение энтропии в химических процессах и при фазовых переходах. Энергия Гиббса как количественная мера вероятности и направленности самопроизвольного протекания химических реакций. Оценка пожарной опасности химических процессов по энергии Гиббса. Для выполнения расчетов можно использовать таблицу 2 приложения.
Пример 7.1. Восстановление оксида железа (III) водородом протекает по уравнению
Fe2O3 + 3H2 = 2Fe + 3H2O(г).
1) Возможна ли эта реакция при нормальных условиях?
2) При какой температуре начнется восстановление железа?
Решение:
1. Ответ на первый вопрос предполагает расчет DG0 реакции. Для этого необходимо рассчитать изменение энтальпии DН0 и изменение энтропии DS0 в данной реакции.
По таблице 1 приложения находим значение DН0 и S0 для всех реагирующих веществ, затем производим вычисления:
DН0р-и = 3DН0(Н2О) - DН0(Fe2О3) = 3×(–241,8) – (–822,2) = 96,8 кДж/моль
DS0р-и = (2S0Fe + 3S0 (H2O))- (S0(Fe2О3) + 3S0 H2) =
= (2×27,1 + 3×188,7) – (87,4 + 3×130,5) = 138,7 Дж/моль×К =
= 138,7 ×10-3 кДж/моль×К
2. Для расчета DG0 реакции воспользуемся формулой Гиббса
DG0р-и =DН0р-и - Т × DS0р-и = 96,8 – 273×138,7 ×10-3 = 58,9 кДж/моль
|
|
|
DG0р-и>0, следовательно, при нормальных условиях реакция невозможна.
3. Для ответа на второй вопрос найдем температуру, при которой
DG0р-и = 0 (состояние равновесия). В этом случае DН0р-и =ТDS0р-и.

Ответ: 1. При нормальных условиях реакция невозможна.
2. Данная реакция начнется при температуре 697 К.
8. ХИМИЧЕСКАЯ КИНЕТИКА
(задачи №№ 176 – 200).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Для усвоения материала данной темы необходимо изучить следующие вопросы. Основные понятия химической кинетики. Гомогенные и гетерогенные системы, гомогенные и гетерогенные реакции. Скорость гомогенной и гетерогенной реакции.
Влияние концентрации реагирующих веществ на скорость химической реакции. Закон действия масс. Константа скорости химической реакции. Молекулярность реакции. Порядок реакции.
Влияние температуры на скорость химической реакции. Эмпирическое правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации химического процесса.
Влияние катализаторов на скорость химической реакции. Гомогенный и гетерогенный катализ. Механизм действия катализаторов.
Пример 8.1. Как изменится скорость реакции получения аммиака при уменьшении давления в системе в 2 раза?
Решение:
1. Запишем выражение для скорости данной реакции
N2 + 3H2 = 2NH3
V = k [N2]×[H2]3
2. При уменьшении давления в системе в 2 раза концентрация реагирующих веществ также уменьшается в 2 раза. Выражение для скорости прямой реакции в этом случае будет
V/ = k [  N2]×[
N2]×[  H2]3 =
H2]3 =  k [N2]×[H2]3
k [N2]×[H2]3
Ответ: скорость реакции уменьшится в 16 раз.
|
|
|
Пример 8.2. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры от 160 до 1900, если температурный коэффициент скорости реакции равен g =2?
Решение:
Для решения задачи воспользуемся формулой Вант-Гоффа:

Тогда в нашем случае

Ответ: скорость реакции увеличится в 8 раз.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
(задачи №№ 201 – 225).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
Виды химических реакций. Константа равновесия обратимой реакции. Влияние температуры, давления, концентрации реагирующих веществ, добавок инертных газов и катализаторов на химическое равновесие. Принцип Ле Шателье и управление реакциями горения.
Характеристика цепных реакций. Цепные реакции как основа процессов окисления. Неразветвленные и разветвленные цепные реакции. Цепные реакции с вырожденным разветвлением.
Пример 9.1. Какими способами можно увеличить выход конечного продукта в следующей обратимой реакции: 2SO2 + O2 + Q «2SO3.
Реакция протекает в газовой фазе.
Решение:
Увеличение выхода конечного продукта SO3 возможно в том случае, если равновесие в данной обратимой реакции будет смещено в сторону образования продукта реакции, т.е. вправо.
Влияние различных условий на смещение равновесия описывается принципом Ле Шателье.
1. Влияние температуры. Данная прямая реакция идет с поглощением тепла, т.е. является эндотермической.
Принцип Ле Шателье: увеличение температуры смещает равновесие в сторону эндотермических реакций (нагрев способствует протеканию эндотермической реакции);
уменьшение температуры смещает равновесие в сторону экзотермических реакций (охлаждение уменьшает выход продуктов эндотермической реакции).
Для увеличения выхода SO3 (для смещения равновесия вправо) необходим нагрев реакционной системы.
2. Влияние давления (учитываются только газообразные вещества).
|
|
|
Реакция протекает в газовой фазе. Исходные вещества занимают больший объем
(3 V). Конечные вещества SO3 только 2 V.
Принцип Ле Шателье: повышение давления (сжатие) сдвигает равновесие в сторону веществ, занимающих меньший объем, т.е. в прямом направлении. Понижение давления (расширение системы) в сторону веществ, занимающих больший объем.
В нашем случае реакция идет с уменьшением объема, следовательно, процесс нужно проводить при высоком давлении. В этом случае выход SO3 увеличится.
3. Влияние концентрации реагирующих веществ.
Принцип Ле Шателье:
Увеличение концентрации исходных веществ увеличивают выход продуктов реакции (сдвигают равновесие в сторону прямой реакции).
Уменьшение концентрации конечных веществ (т.е. отвод продуктов реакции из системы) увеличивает выход продуктов реакции (сдвигают равновесие в сторону прямой реакции).
Увеличение концентрации конечных веществ сдвигает равновесие в сторону обратной реакции (не способствует выходу продуктов реакции).
В данной задаче для увеличения выхода SO3 необходимо увеличить концентрации исходных SO2 и O2, и уменьшить концентрацию SO3 (т.е. обеспечить отвод продуктов реакции).
10. ХИМИЧЕСКИЕ ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОЙ ЭНЕРГИИ
(задачи №№ 226 – 250).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
3. Коробейникова Е.Г., Кожевникова Н.Ю., Свидзинская Г.Б. Электрохимические процессы. Учебное пособие. - СПб.: СПбИПБ МВД РФ, 1998, 61 с.
При изучении темы обратите внимание на следующие основные вопросы.
Скачок потенциала на границе раздела фаз в электрохимической системе. Двойной электрический слой и его строение. Гальваническая цепь. ЭДС гальванического элемента. Электродные потенциалы. Ряд напряжений металлов. Уравнение Нернста.
|
|
|
Классификация гальванических элементов. Первичные, вторичные, концентрационные, топливные элементы. Химические источники электрической энергии. Аккумуляторы.
Электролиз. Особенности электрохимических реакций при электролизе. Пожарная опасность процессов электролиза.
Для выполнения заданий можно воспользоваться таблицей электродных потенциалов (таблица 2 приложения).
Пример 10.1. Вычислить значение потенциала медного электрода в
0,01 М растворе сернокислой меди (CuSO4).
Решение:
При стандартных условиях электродные потенциалы имеют строго определенные значения, приведенные в таблице 2 приложения.
Для условий, отличных от стандартных, электродные потенциалы могут быть рассчитаны по уравнению Нернста
 , где
, где
E - электродный потенциал, B;
E0 - стандартный электродный потенциал, B;
R - универсальная газовая постоянная, R = 8,31 Дж/моль×К;
T - абсолютная температура, K;
F - число Фарадея, F = 9.6485×104 Кл;
n - степень окисления ионов металлов.
Уравнение Нернста после подстановки в него значений R, F и T приобретает для 250С (298 К) следующий вид:
 .
.
1. По условию задачи медный электрод не является стандартным. Значение электродного потенциала находим по уравнению Нернста.
Е0 (Cu/Cu2+) = 0,34 В, [ Cu2+] = 0,01 = 10-2 М, заряд ионов меди n = 2,
следовательно,
 0,281 В.
0,281 В.
Ответ: потенциал медного электрода 0,281 В.
Пример 10.2. Рассчитать значение потенциала водородного электрода при стандартном давлении и рН = 6.
Решение:
Потенциал стандартного водородного электрода условно принят равным 0. При концентрации ионов водорода, отличной от 1 М, потенциал необходимо рассчитать, используя уравнение Нернста.
При рН = 6 концентрация ионов водорода составит
[H+] = 10-pH = 10-6 моль/л.
Тогда потенциал водородного электрода составит

Ответ: потенциал водородного электрода – 0,354 В.
Пример 10.3. Рассчитать ЭДС гальванического элемента, состоящего из магниевого и свинцового электродов, погруженных в растворы их солей с концентрацией ионов магния 0,0001 М и ионов свинца 0,001 М. Составить схему гальванического элемента, записать полуреакции, протекающие на электродах.
Решение.
Значение электродных потенциалов находим по уравнению Нернста
 .
.
Е0 (Mg/Mg2 +) = – 2,37 В, [ Mg2 +] = 0,0001 = 10-4 моль/л, заряд ионов магния
n = +2, следовательно:
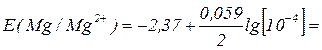 – 2, 448 В.
– 2, 448 В.
Е0(Pb/Pb2 +) = + 0.99 В, [ Pb2 +] = 0.001 = 10-3 моль/л, заряд ионов свинца
n = +2, следовательно:
 0,902 В.
0,902 В.
Е (Mg/Mg2 +) < Е (Pb/Pb2 +), следовательно, электрод магния является анодом.
Схема гальванического элемента:
Mg ½ Mg2+ (Mg2+ 10-4)½½ Pb ½ Pb2+ (Pb2+ 10-3)
а н о д к а т о д
Реакция на аноде: Mg 0- 2 e- = Mg2+
Реакция на катоде: Pb2+ + 2 e- = Pb0
|
|
|
ЭДС гальванического элемента определяем по формуле:
ЭДС = E Pb – E Mg = 0,902 – (– 2, 488) = 3,39 В
Ответ: ЭДС гальванического элемента 3,39 В.
11. КОРРОЗИЯ МЕТАЛЛОВ
(задачи №№ 251 – 275).
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
4. Коробейникова Е.Г., Кожевникова Н.Ю., Свидзинская Г.Б. Электрохимические процессы. Учебное пособие. - СПб.: СПбИПБ МВД РФ, 1998, 61 с.
Необходимо познакомиться с основными видами и механизмом коррозионных процессов. Химическая и электрохимическая коррозия металлов. Методы защиты от коррозии (протекторная, катодная, анодная, химическая, антикоррозионные покрытия).
Для выполнения заданий можно воспользоваться таблицей электродных потенциалов (таблица 2 приложения).
12. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
(задачи №№ 276 – 300).
Литература:
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
3. Коробейникова Е.Г., Родионов В.А., Свидзинская Г.Б. «Свойства растворов». Учебно-методическое пособие. – СПб.: СПб институт ГПС МЧС России, 2003, 54 с.
Тема предполагает подробное изучение следующих основных вопросов. Теория электролитической диссоциации Аррениуса. Катионы и анионы. Гидратация ионов по И.А. Каблукову. Современные представления о процессе диссоциации.
Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации слабых электролитов. Закон разбавления Оствальда. При расчетах следует пользоваться таблицей 3 приложения.
Диссоциация кислот, гидроксидов, солей в свете теории электролитической диссоциации. Ионно-молекулярные уравнения.
Диссоциация воды. Ионное произведение воды. Водородный показатель рН.
Растворы солей в воде. Понятие произведения растворимости и факторов, на него влияющих. Растворимость солей в воде. Жесткость воды и способы ее устранения. Использование пенообразователей в воде с различной жесткостью.
Гидролиз солей. Константа гидролиза. Факторы, влияющие на степень гидролиза.
Пример 12.1. Вычислить рН 10-4 М раствора гидроксида калия.
Решение:
Гидроксид калия – сильный электролит и полностью диссоциирует в водном растворе:
КОН «К+ + ОН-.
Концентрация ионов ОН- равна исходной концентрации щелочи КОН.
[ОH-] = 10-4 моль/л
Используя ионное произведение воды, рассчитаем концентрацию ионов Н+ в растворе:
[H+] = 10-14 /[ОH-] = 10-14/10-4 = 10-10 моль/л.
Вычислим рН данного раствора щелочи.
рН = -lg[H+] = - lg 10-10 = 10
Пример 12.2. Определить рН 0,1 М раствора муравьиной кислоты, если ее константа диссоциации составляет Кдис. = 2,5×10-4.
Решение:
Уравнение диссоциации муравьиной кислоты
НСООН «Н+ + СООН-.
Воспользуемся формулой
[H+] =  =
=  = 5×10-3 моль/л
= 5×10-3 моль/л
Рассчитаем рН раствора:
рН = -lg[H+] = - lg 5×10-3 = 3- lg 5 = 3-0,7 = 2,3
13. СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
(задачи №№ 301 – 325).
Литература:
Литература:
1. Глинка Н.Л. Общая химия. – Учебное пособие для вузов/ Под ред. В.А. Рабинович. – изд.30-е, перераб. – М.:Интеграл-Пресс, 2007. – 728 с.
2. Е.Г. Коробейникова, А.П. Чуприян, В.Р. Малинин, Г.К. Ивахнюк, Н.Ю. Кожевникова. Химия. Курс лекций. Учебное пособие по спец. 280104.65 – Пожарная безопасность. /Под ред. Проф. В.С.Артамонова СПб.: СПб ГПС МЧС России, 2011 г. – 425 с.
3. Коробейникова Е.Г., Родионов В.А., Свидзинская Г.Б. «Свойства растворов». Учебно-методическое пособие. – СПб.: СПб институт ГПС МЧС России, 2003, 54 с.
При изучении данной темы основными вопросами являются следующие.
Классификация растворов. Способы выражения состава растворов.
Вода. Нахождение в природе. Состав и строение молекулы воды. Основные физико-химические свойства воды. Жесткость воды и способы ее устранения.
Образование растворов. Сольватация и гидратация. Теория образования растворов Д.И. Менделеева. Термодинамические основы процесса растворения. Суммарный тепловой эффект растворения вещества.
Растворимость и факторы, влияющие на нее: природа вещества и растворителя, агрегатное состояние, внешние условия (температура, давление). Растворимость газов в жидкостях. Закон Генри. Парциальное давление, закон Дальтона. Взаимная растворимость жидкостей. Растворимость твердых веществ в жидкостях.
Пример13.1. В герметичной емкости объемом 30 м3, заполненной на 1/3, давление паров ацетона при температуре 300С составляет 190 мм рт.ст. Определить концентрацию паров ацетона в % и объем его паров в м3.
Решение:
1. Объемная концентрация паров (газов) в замкнутом объеме рассчитывается через давление насыщенного пара по формуле:
 , %,
, %,
где
jОБ - объемная концентрация газа или пара, %;
Р S- давление насыщенного пара при данной температуре, мм рт.ст., кПа,
МПа, атм; Р s рассчитывают по уравнению Антуана или определяют по
номограмме (если не дано по условию задачи).
Р АТМ - внешнее давление, мм рт.ст., кПа, МПа, атм.
В условии данной задачи величина атмосферного давления не указана, поэтому принимаем его равным нормальному атмосферному давлению.
Определим объемную концентрацию паров ацетона:
 25 %
25 %
2. По условию задачи в емкости жидкий ацетон занимает 1/3 всего объема. Следовательно, газообразная фаза, в которую входят пары ацетона и воздух, составляет 2/3 объема емкости или
30 × (1/3) = 10 м3.
25 % этого объема составляют пары ацетона. Определим объем паров ацетона в м3:
10 × 0,25 = 2,5 м3
Ответ: объемная концентрация паров ацетона составляет 25 %;
объем паров ацетона составляет 2,5 м3.
|
|
|


