 |
Химические свойства карбоновых кислот и
|
|
|
|
СЛОЖНЫХ ЭФИРОВ (задачи №№ 176 – 200)
Литература:
Н.Л. Глинка. Общая химия. – Л.: Химия, 1988, гл.XV, п. 172-173, с. 471 – 475.
Пример 8.1. На примере пропановой (пропионовой) кислоты охарактеризуйте химические свойства карбоновых кислот.
Решение:
1. Свойства гидроксильного водорода
1.1 Взаимодействие с активными металлами:
2СН3 – СН2 – С = О + 2Na ® 2СН3 – СН2 – С = О + H2
½ ½
OH ONa
пропановая кислота натриевая соль пропановой кислоты
1.2. Взаимодействие с основными оксидами (металлов I –II групп):
2СН3 – СН2 – СООН + СаО ® (СН3 – СН2 – СОО)2Са + H2О
пропановая кислота кальциевая соль пропановой кислоты
1.3. Взаимодействие со щелочами:
СН3 – СН2 – СООН + КОН ® СН3 – СН2 – СООК + H2О
пропановая кислота калиевая соль пропановой кислоты
1.4. Взаимодействие с карбонатом натрия – качественная реакция на карбоксильную группу (выделение углекислого газа).
СН3 – СН2 – СООН + Na2СО3 ® СН3 – СН2 – СООNa + H2О + CO2
пропановая кислота натриевая соль пропановой кислоты
2. Свойства гидроксильной группы
2.1. Взаимодействие со спиртами – реакция этерификации – образование сложных эфиров:
Н2SO4 конц.
СН3 – СН2 – С – ОН + НO – СН2 – СН3 ¾¾® СН3 – СН2 – С – О– СН2 – СН3 + Н2О
ll ll
О О
пропановая кислота этанол этиловый эфир пропановой кислоты
(этилпропаноат)
3. Взаимодействие с галогенами. Происходит замещение атома водорода у второго углеродного атома цепи (в a-положении).
СН3 – СН2 – С – ОН + Br2 ® СН3 – СН – С – ОН + НBr
ll ½ ll
O Br O
пропановая кислота 2-бромпропановая кислота
(a-бромпропионовая кислота)
4. Реакции окисления. Полное окисление – горение:
С3Н6О2 + 3,5О2 ® 3СО2 + 3Н2О
Пример 8.2. На примере пропилового эфира уксусной кислоты напишите реакции, характеризующие основные химические свойства и способы получения сложных эфиров.
|
|
|
Решение:
1. Получение – реакция этерификации – кислота + спирт.
Н2SO4 конц.
СН3 – С – ОН + ОН – СН2 – СН2 –СН3 ¾¾® СН3 – С – О– СН2 – СН2 –СН3 + Н2О
ll ll
О О
уксусная кислота пропанол-1 пропиловый эфир уксусной кислоты
(этановая) (пропилэтаноат)
2. Основное химическое свойство – гидролиз сложных эфиров – расщепление сложных эфиров под действием воды. Эта реакция обратна реакции этерификации. Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН–).
Н+,(Н2SO4 разб.)
СН3 – С – О– СН2 – СН2 –СН3 + Н2О ¾¾® СН3 – С – ОН + ОН – СН2 – СН2 –СН3
ll ll
О О
пропиловый эфир уксусной кислоты уксусная пропанол-1
(пропилэтаноат) кислота
ОН–,(NaОН)
СН3 – С – О– СН2 – СН2 –СН3 + Н2О ¾¾® СН3 – С – ОNa + ОН – СН2 – СН2 –СН3
ll ll
О О
пропиловый эфир уксусной кислоты ацетат пропанол-1
(пропилэтаноат) натрия
В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
В растворах разбавленных минеральных кислот соли карбоновых кислот вновь превращаются в исходную карбоновую кислоту:
2СН3СООNa + H2SO4 разб. ® 2СН3СООН + Na2SO4
ацатат натрия уксусная кислота
ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
(задачи №№ 201 – 225)
Литература:
Н.Л. Глинка. Общая химия. – Л.: Химия, 1988, гл.XV, п. 166-167, с. 458 – 463.
Пример 9.1. Напишите структурные формулы и назовите ароматические изомеры состава С8Н10.
Решение:
| С – С2Н5 // \ HС СH ç çç HС СH \\ / СH | 1 С – СН3 6// \ 2 HС С– СН3 ç5 çç3 HС СН \\ 4 / СH | С– СН3 // \ HС СH ç çç HС С– СН3 \\ / СH | С– СН3 // \ HС СH ç çç HС СH \\ / С– СН3 |
| этилбензол | 1,2-диметилбензол, | 1,3-диметилбензол, | 1,4-диметилбензол, |
| орто-диметилбензол, о-диметилбензол, о-ксилол | мета-диметилбензол, м-диметилбензол, м-ксилол | пара-диметилбензол, п-диметилбензол, п-ксилол |
|
|
|
Пример 9.2. На примере метилбензола (толуола) напишите уравнения реакций, характеризующих химические свойства аренов.
Решение:
1. Для ароматических соединений (производных бензола) наиболее характерными реакциями являются реакции замещения атомов водорода без разрыва бензольного кольца. Для гомологов бензола под действием радикалов (– СН3, – С2Н5 и т.п.) атомы водорода бензольного кольца в положении 2,4,6 становятся более реакционноспособными.
1.1. Галогенирование
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | + Br2 ¾¾® | 6 СН 5// \1 HС С– СН3 ç4 çç2 HС С – Br \\ 3 / СH 2-бромметилбензол (о-бромметилбензол) | + HBr |
| И | |||
| СН // \ HС С– СН3 ç çç Br – С СН \\ / СH 4-бромметилбензол (п-бромметилбензол) |
При избытке брома
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | FeBr3 + 3Br2 ¾¾® | С – Br // \ HС С– СН3 ç çç Br – С С – Br \\ / СH 2,4,6-трибромметилбензол | + 3HBr |
1.2. Нитрование
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | H2SO4 конц. + OHNO2 ¾¾® | СН // \ HС С– СН3 ç çç HС С– NO2 \\ / СH 2-нитрометилбензол (о-нитрометилбензол) | + H2O |
| и | |||
| СН // \ HС С– СН3 ç çç O2N –С СН \\ / СH 4-нитрометилбензол (п-нитрометилбензол) |
При избытке азотной кислоты
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол (толуол) | H2SO4 конц. + 3OHNO2 ¾¾® | С– NO2 // \ HС С– СН3 ç çç O2N –С С– NO2 \\ / СH2,4,6-тринитрометилбензол (тринитротолуол) | + 3H2O |
1.3. Алкилирование
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | AlCl3 + С2Н5Cl ¾¾® | СН // \ HС С– СН3 ç çç HС С– C2H5 \\ / СH 1-метил-2-этилбензол (о-метилэтилбензол) | + HCl |
| и | |||
| СН // \ HС С– СН3 ç çç C2H5 – С СН \\ / СH 1-метил-4-этилбензол (п-метилэтилбензол) |
|
|
|
2. Реакции замещения атомов водорода в алкильном радикале - галогенирование
| СН // \ HС С– СН3 ç çç HС СН \\ / СH | hn + Cl2 ¾¾® | СН // \ HС С– СН2Cl ç çç HС СH \\ / СH | + HCl |
3. Реакции присоединения, идущие с разрывом кратной связи в бензольном кольце
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | t, Ni, Pt + 3Н2 ¾¾® | СН2 / \ Н2С СН – СН3 ç ç Н2С СН2 \ / СН2 метилциклогексан |
4. Термическое разложение
t0
С6Н5СН3 ¾® 7С + 4Н2
5. Реакции окисления
5.1. Полное окисление – горение:
С6Н5СН3 + 9О2 ® 7СО2 + 4Н2О
5.2. Неполное окисление (для всех гомологов бензола):
| СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | р-р КMnO4 + [O] ¾¾® кипячение | СН // \ HС С– С = O ç çç ç HС СH OH \\ / СH бензойная кислота | + H2O + CO2 |
Пример 9.3. Напишите уравнения реакций, с помощью которых можно получить ароматические соединения на примере метилбензола.
Решение:
1. Ароматизация алканов (каталитическая дегидроциклизация).
Реакция Зелинского-Казанского.
1.1. ароматизация гептана
| I стадия: циклизация алкана (образуются производные циклогексана) | |||
| 1 6 СН3 – СН2 – СН2 – СН2 – СН2 – СН2 – СН3 гептан | t, Pt ¾¾® | СН2 / \ Н2С СН – СН3 ç ç Н2С СН2 \ / СН2 Метилциклогексан | + Н2 |
| II стадия: дегидрирование производных циклогексана (образуются арены) | |||
| СН2 / \ Н2С СН – СН3 ç ç Н2С СН2 \ / СН2 Метилциклогексан | t, Pt ¾¾® | СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | + 3Н3 |
В общем виде
t, Pt
С7Н16 ¾¾® С6Н5СН3 + 4Н2
1.2. ароматизация 2-метилгексана или 3-метилгексана
| 1 6 СН3 – СН2 – СН – СН2 – СН2 –СН3 ç СН3 3-метилгексан | t, Pt ¾¾® | СН2 / \ Н2С СН – СН3 ç ç Н2С СН2 \ / СН2 метилциклогексан | + Н2 |
| СН2 / \ Н2С СН – СН3 ç ç Н2С СН2 \ / СН2 Метилциклогексан | t, Pt ¾¾® | СН // \ HС С– СН3 ç çç HС СН \\ / СH метилбензол | + 3Н3 |
|
|
|
2. Реакция Вюрца – Фиттига
| СН // \ HС С– Br ç çç HС СН \\ / СH бромбензол | t 0 + BrCH3 + 2Na ¾® бромметан | СН // \ HС С– СН3 ç çç HС СH \\ / СH метилбензол | + 2NaBr |
3. Алкилирование бензола (реакция Фриделя-Крафтса)
| СН // \ HС СН ç çç HС СН \\ / СH бензол | AlCl3 + ClCH3 ¾® хлорметан | СН // \ HС С– СН3 ç çç HС СH \\ / СH метилбензол | + HCl |
10. РАСЧЕТЫ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
(задачи №№ 226 – 250)
Пример 10.1. Какой объем этана С2Н6 сгорел, если в результате образовалось 6 кг паров воды? Температура 200С, давление 98 кПа.
Решение:
1. Составляем уравнение реакции горения этана в воздухе.
Х м3 6 кг
С2Н6 + 3,5(О2 + 3,76 N2) = 2СО2 + 3Н2О + 3,5 × 3,76 N2
1× VМ = 3× М =
= 24,9 м3 = 3×18 кг
2. В соответствии с условием задачи в уравнении реакции над формулами веществ записываем неизвестные и известные величины с указанием размерности.
Под формулами веществ записываем
- молярную массу (М кг/кмоль) соответствующего вещества (в том случае, если дана масса или надо определить массу в кг) или
- молярный объем (VМ м3/кмоль) вещества, находящегося в газовой фазе (в том случае, если дан объем или надо определить объем в м3).
Стехиометрические коэффициенты, стоящие в уравнении реакции и обозначающие число кмоль веществ, вступивших в реакцию или образовавшихся в результате реакции, необходимо учитывать, умножая М или VМ на соответствующий стехиометрический коэффициент.
Молярная масса воды VМ = 18 кг/кмоль. В данной задаче стехиометрический коэффициент перед Н2О равен 3, поэтому под формулой воды следует написать 3× М = 3×18 кг.
Если условия отличаются от нормальных, то необходимо определить, какой объем будет занимать 1 кмоль любого газообразного вещества при данных условиях. Расчет VМ ведут по формуле объединенного газового закона:
 , где
, где
Р и Т – данные в задаче температура и давление.
Для нашей задачи рассчитываем молярный объем при заданных условиях:  м3/кмоль.
м3/кмоль.
Размерность Р0 должна соответствовать размерности давления, приведенного в условии задачи.
Найденное значение VМ подставляем под формулой этана (стехиометрический коэффициент перед горючим веществом всегда должен быть равен 1!).
3. Определим объем сгоревшего этана. Согласно уравнению реакции можно составить следующую пропорцию:
|
|
|
24,9 м3 С2Н6 соответствуют 3×18 кг Н2О
Х м3 С2Н6 соответствуют 6 кг Н2О.
Отсюда
 м3.
м3.
Ответ: сгорело 2,76 м3 этана.
Пример 10.2. Какой объем воздуха необходим для полного сгорания 10 кг диэтилового эфира С2Н5ОС2Н5? Температура 100С, давление 1,2 ат
Решение:
1. Записываем уравнение реакции горения
10 кг Х м3
С2Н5ОС2Н5 + 6(О2 + 3,76N2) =4СО2 + 5Н2О +6×3,76N2
М = 74 кг 6×4,76 × Vм =
=6×4,76×19,35 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса диэтилового эфира 74 кг/кмоль. Записываем эту величину под формулой эфира.
4. Рассчитаем, какой объем занимает 1 кмоль воздуха (как и любого другого газообразного вещества) при данных температуре и давлении.
 м3/кмоль
м3/кмоль
 Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).
Записываем данную величину под формулой воздуха, умножив ее на стехиометрический коэффициент (6×4,76).
5. По уравнению реакции найдем объем воздуха, необходимого для полного сгорания эфира:
 м3
м3
Ответ: для сгорания 10 кг диэтилового эфира необходимо 74,7 м3 воздуха.
Пример 10.3. Какая концентрация углекислого газа (в объемных %) образовалась в помещении объемом 500 м3, если сгорело 5 кг ацетона СН3СОСН3?
Температура –50С, давление 750 мм рт.ст.
Решение:
Объемная концентрация газа в помещении определяется по формуле

В данной задаче необходимо определить объем углекислого газа, который образуется в результате реакции горения.
1. Составляем уравнение реакции горения ацетона в воздухе:
5 кг Х м3
СН3СОСН3 + 4(О2 + 3,76 N2) = 3СО2 + 3Н2О + 4 × 3,76 N2
М = 58 кг 3× VМ =
= 3×22,3 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса ацетона 58 кг/кмоль. Записываем эту величину под формулой ацетона.
4. Рассчитаем, какой объем занимает 1 кмоль углекислого газа (как и любого другого газообразного вещества) при данных температуре и давлении.
 м3/кмоль.
м3/кмоль.
Записываем данную величину под формулой углекислого газа, умножив ее на стехиометрический коэффициент 3.
5. По уравнению реакции найдем объем углекислого газа, образовавшегося в результате сгорания ацетона:
 м3.
м3.
6. Рассчитаем объемную концентрацию углекислого газа в помещении:
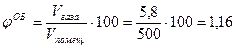 %.
%.
Ответ: объемная концентрация углекислого газа составила 1,16 %.
Пример 10.4. Образовалась ли в емкости объемом 0,5 м3 взрывоопасная концентрация ацетилена при взаимодействии в ней 0,1 кг карбида кальция с водой? Условия нормальные.
Решение:
1. В результате реакции образуется гидроксид кальция и горючий газ ацетилен. Концентрация ацетилена в газо-воздушной смеси от 2 до 80 % взрывоопасна.
Запишем уравнение реакции взаимодействия карбида кальция с водой.
0,1 кг х м3
СаС2 + 2Н2О = Са(ОН)2 + С2Н2
М = 64 кг VМ = 22,4 м3
2. Записываем в уравнении известные и неизвестные величины с указанием размерности.
3. Молярная масса карбида кальция 64 кг/кмоль. Записываем эту величину под формулой карбида кальция.
4. Для расчета концентрации газа в емкости необходимо определить объем образовавшегося ацетилена. По условию задачи условия нормальные, следовательно, молярный объем VМ = 22,4 м3. Записываем эту величину под формулой ацетилена.
5. В соответствии с уравнением реакции рассчитываем объем образовавшегося ацетилена:
 м3
м3
6. Рассчитаем объемную концентрацию ацетилена в емкости:
 %.
%.
Ответ: объемная концентрация ацетилена в емкости взрывоопасна и
составляет 7 %.
Литература
1. Н.Л. Глинка. Общая химия: Учебное пособие для вузов. – Л.: Химия, 1988, 704 с.
2. К.Н. Зеленин. Химия: Учебник для медицинских вузов. – СПб: Специальная литература, 1997. – 688 с.
3. В.М. Потапов, С.Н. Татаринчик. Органическая химия. – М., Химия, 1972, 325 с.
4. В.Б. Воловик, Е.Д. Крутецкая. Органическая химия: Упражнения и задачи. – СПб.: Оракул, 1997, 126 с.
5. В.М. Потапов, С.Н. Татаринчик, А.В. Аверина. Задачи и упражнения по органической химии. – М.: Химия, 1975, 208 с.
| Содержание | ||
| 1. | Задачи на вывод химической формулы ……………………… | |
| 2. | Номенклатура предельных углеводородов ………………….. | |
| 3. | Химические свойства предельных углеводородов …………. | |
| 4. | Номенклатура непредельных углеводородов ……………….. | |
| 5. | Химические свойства непредельных углеводородов ………. | |
| 6. | Номенклатура кислородсодержащих органических соединений …………………………………………………….. | |
| 7. | Химические свойства спиртов, простых эфиров, альдегидов и кетонов ……………………………………………………….. | |
| 8. | Химические свойства карбоновых кислот и сложных эфиров | |
| 9. | Циклические соединения ……………………………………… | |
| 10. | Расчеты по уравнениям химических реакций ……………….. | |
| Литература …………………………………………………….. |
Под общей редакцией
|
|
|


