 |
Задание для самоконтроля № 5.
|
|
|
|
Составить уравнения самостоятельно:
PbO2 + HCl à PbCl2 + Cl2 + H2O
Mn + O2 à Mn2O7
Zn + HNO3 à Zn(NO3)2 + NH4NO3 + H2O
CuI2 à CuI + I2
H2S + H2SO4 à S + H2O
NaI + NaNO2 + H2SO4à I2 + NO2 + Na2SO4 + H2O
Как видно из уравнивания процессов, в которых получается большое количество продуктов, очень много приходится балансировать по атомам в конце уравнивания (водородных атомов, кислотных остатков). Существует еще один метод, в котором коэффициенты перед атомами воды или кислоты можно получить после электронного баланса.
Б) МЕТОД ИОННО - ЭЛЕКТРОННЫЙ (ПОЛУРЕАКЦИЙ) основан на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее ионное уравнение:

 MnO4- +8H+ + 5 e à Mn2+ + 4 H2O 2 в-ие, ок-ль
MnO4- +8H+ + 5 e à Mn2+ + 4 H2O 2 в-ие, ок-ль
NO2- + H2O - 2 e à NO3-- + 2H+ 5 ок-ие, в-ль
2MnO4- +16H+ + 5NO2- + 5H2O à 2Mn2+ + 8 H2O + 5NO3-- + 10H+
2KMnO4 + 5 NaNO2 + 3H2SO4 à 5NaNO3 + 2 MnSO4 + K2SO4 + 3 H2O
Область использования метода и его особенности.
• этот метод чаще используют для уравнения сложных реакций, приведенных выше в примерах 3 и 4;
• этим методом уравнивают реакции, протекающие в растворах.
• не обязательно знать и рассчитывать степени окисления элементов; достаточно знать какое вещество выступает в качестве окислителя, а какое - в качестве восстановителя;
• в полуреакциях кроме реагирующих ионов восстановителей и окислителей, баланс можно устанавливать с помощью молекул воды - Н2О, катионов водорода -Н + , анионов гидроксогруппы - ОН-; все зависит от среды, в которой протекает реакция; ионы Н+ и ОН- могут освобождаться из молекул
воды или связываться в нее, отдавая атомы водорода или ОН- в новые вещества или «прихватывая» их из исходных соединений.
• в полуреакциях записывают ионы исходных веществ, содержащие элементы восстановители и окислители, а также ионы полученных из них продуктов реакции. Это правило выполняется для сильных электролитов. Слабые электролиты и не электролиты записываем полностью в виде молекул (вода, газы оксиды, осадки, комплексные ионы, простые вещества);
|
|
|
• удобно уравнивать реакции с участием органических веществ.
Правила уравнивания в различных средах:
Кислая среда
Рассмотрим реакцию из примера 4:
Na2SO3 + KM n O4 + H2SO4 à MnSO4 +K2SO4 + Na 2 SO 4 +H 2O
Сульфит натрия выступает в качестве восстановителя, перманганат калия выступает в качестве окислителя (смотри классификацию окислителей и восстановителей); оба эти соединения - сильные электролиты.
Записываем полуреакции с ионами, в составе которых есть элементы окислители и восстановители:
SO3-2 à SO42-
MnO4- à Mn2+
В одном из ионов в каждой полуреакции присутствует избыток атомов кислорода, а в другом (в противоположной части уравнения) – атомов кислорода меньше.
Так в первой полуреакции кислорода больше на 1 атом справа, а во второй полуреакции кислорода больше слева на 4 атома.
В стороне с меньшим числом атомов «О» добавляем молекулы воды в количестве, равном разнице числа атомов кислорода:
 SO3-2 + H2O à SO42-
SO3-2 + H2O à SO42-
(уравняли число атомов «О»)
 MnO4- à Mn2+ + 4H2O
MnO4- à Mn2+ + 4H2O
В стороне с большим числом атомов кислорода записываем катионы водорода количеством, равным числу атомов водорода в молекулах воды (если нет «Н» в других частицах):
 SO3-2 + H2O à SO42- + 2 H+
SO3-2 + H2O à SO42- + 2 H+
 (уравняли число атомов «Н»)
(уравняли число атомов «Н»)
MnO4- +8 H+ à Mn2+ + 4H2O
Подсчитываем общее число зарядов слева и справа:
SO3-2 + H2O à SO42- + 2 H+
 | |||||||
 |  | ||||||
 | |||||||
-2 + 0 = -2 -2 + (+2) = 0
MnO4- + 8 H+ à Mn2+ + 4H2O
 | |||||||
 |  |  | |||||
-1 + (+8) = +7 +2 + 0 = +2
|
|
|
В левой части записать такое количество электронов, которое уходит от восстановителя и присоединяется к окислителю:
SO3-2 + H2O - 2ē à SO42- + 2 H+
 |  |  |  |
-2 + 0 = -2 -2 + (+2) = 0 (от-2 до 0 ушли 2 ē)
MnO4- + 8 H+ + 5ē à Mn2+ + 4H2O
 | |||||||
 | |||||||
 | |||||||
 | |||||||
-1 + (+8) = +7 +2 + 0 = +2 (от +7 до +2 пришли 5 ē)
Далее, как и в методе электронного баланса рассчитываем значение наименьшего общего кратного и значения дополнительных множителей:


 SO3-2 + H2O - 2ē à SO42- + 2 H+ 5 восст-ль, окисление
SO3-2 + H2O - 2ē à SO42- + 2 H+ 5 восст-ль, окисление
MnO4- +8 H+ + 5ē à Mn2+ + 4H2O 2 ок-ль, восстановление
Суммируем левую и правую части, умножая число частиц на дополнительные множители:
5 SO3-2 +5 H2O + 2MnO4- +16 H+ ----à5 SO42- +10H+ +2 Mn2+ + 8H2O
и уничтожаем в левой и правой частях одинаковые частицы:
 |  |  |
 5 SO3-2 +5 H2O + 2MnO4- +16 H+ ----à5 SO42- +10H+ +2 Mn2+ + 8H2O
5 SO3-2 +5 H2O + 2MnO4- +16 H+ ----à5 SO42- +10H+ +2 Mn2+ + 8H2O
6 3
Проверяем суммарные заряды слева и справа:
5 SO3-2 + 2MnO4- +6 H+ à5 SO42- + 2 Mn2+ + 3H2O


- 10 + (-2) + (+6) = -6 -10 + (+4) + 0 = -6,
Вывод: баланс составлен правильно.
Переносим коэффициенты к соответствующим молекулам (в том числе к молекулам воды и серной кислоты: это 1-ое преимущество перед методом электронного баланса):
5Na2SO3 + 2KMnO4 + 3H2SO4 à 5Na2SO4 + K2SO4 +2MnSO4 +3H2O
Затем проверяем количества атомов калия (К): здесь уже в наличии равенство: 2К = К2
Для большей уверенности просчитываем баланс по атомам серы
(можно не делать в этом случае).
Проверяем равенство атомов кислорода: 35 = 35
Фактически, запись всего процесса уравнивания должна выглядеть короче, так как большинство действий проводим устно и записываем у одних и тех же полуреакций:
5Na2SO3 + 2KMnO4 + 3H2SO4 à 5Na2SO4 + K2SO4 +2MnSO4 +3H2O


 SO3-2 + H2O - 2ē à SO42- + 2 H+ 5 восст-ль, окисление
SO3-2 + H2O - 2ē à SO42- + 2 H+ 5 восст-ль, окисление
MnO4- +8 H+ + 5ē à Mn2+ + 4H2O 2 ок-ль, восстановление
 | |||||||||
 |  |  |  | ||||||
5 SO3-2 +5 H2O + 2MnO4- +16 H+ à 5 SO42- +10H+ +2 Mn2+ + 8H2O
6 3
- 10 + (-2) + (+6) = -6 -10 + (+4) +0 = -6,
Реально процесс, протекающий в ОВР в кислой среде сопровождается освобождением избыточного кислорода в форма О2- и связыванием каждой такой частицы двумя катионами водорода 2Н+ в воду (смотри сводную таблицу ниже)
Щелочная среда
|
|
|
Na2SO4 + KM n O4 + NaOH à K 2M n O4 +Na2 MnO4 +Na 2 SO 4+H2O
Сульфит натрия выступает в качестве восстановителя;
Перманганат калия выступает в качестве окислителя.
Записываем полуреакции с ионами, в составе которых есть элементы окислители и восстановители:
SO3-2 à SO42-
MnO4- à MnО2-
В первой полуреакции атомов кислорода больше на 1 атом справа, а во второй полуреакции количества кислорода одинаковое.
В стороне с меньшим числом атомов «О» добавляем гидроксид-ионы в количестве в два раза большем от разницы атомов кислорода:
SO3-2 + 2ОН- à SO42-

 (уравняли число атомов «О»)
(уравняли число атомов «О»)
MnO4- à MnО2-
В стороне с большим числом атомов кислорода (SO42-) записываем молекулы воды, в количестве, равном разнице атомов кислорода:
SO32- + 2 OH - à S O42- + H2O
 (уравняли число атомов «Н»)
(уравняли число атомов «Н»)
MnO4- à MnO42--

Подсчитываем общее число зарядов слева и справа:
 SO3-2 + 2OН- à SO42- + H2O
SO3-2 + 2OН- à SO42- + H2O
 | |||||
 |  | ||||
-2 + (-2) = -4 -2 + 0 = -2
MnO4- à MnО2-
 | |||||||
 | |||||||
 | |||||||
 | |||||||
-1 -2
В левой части записать такое количество электронов, которое уходит от восстановителя и присоединяется к окислителю:
SO3-2 + 2OН- -2 ē à SO42- + H2O
 | |||||||
 |  | ||||||
 | |||||||
-2 + (-2) = -4-2 + 0 = -2
MnO4- + 1 ē à MnО2-
 | |||||||
 | |||||||
 |  | ||||||
-1 -2
Рассчитиываем НОК и дополнительные множители:

 SO3-2 + 2OН- -2 ē à SO42- + H2O 1 восст-ль, окисление
SO3-2 + 2OН- -2 ē à SO42- + H2O 1 восст-ль, окисление
MnO4- + 1 ē à MnО2- 2 ок-ль, восстановление
Суммируем левую и правую части, умножая число частиц на дополнительные множители:
SO32- + 2OH- +2 MnO4-- + à SO42- + H2O + 2 MnO42--



(2-)+ (2-) + (2-) = 6- (2-) + 0 + (4-) = 6-
Баланс верен, так как -6 = -6
Переносим коэффициенты к соответствующим молекулам (в том числе к молекулам воды и щелочи):
Na2SO3 + 2 KM n O4 + 2 NaOH à K2M n O4 +Na2 MnO4 +Na 2 SO 4+H2O
Проверяем: выполняется ли баланс по атомам. Баланс выполняется. Уравнение составлено верно.
Нейтральная среда
|
|
|
Для уравнивания реакции, протекающей в нейтральной среде можно использовать молекулы водорода, гидроксид-анионы и катионы водорода.
Если в полуреакции избыток атомов кислорода находится в правой части, то составляем ее по правилам уравнивания в кислой среде (используем Н2О и Н+).
Если избыток атомов кислорода находится в левой части, - то по правилам уравнивания в щелочной среде.
Возьмем пример превращения того же сульфита натрия под действием перманганата калия в нейтральной среде (то есть, задано присутствие воды):
Na2SO3 + KM n O4 + H2O à MnO2 + Na 2 SO 4 + КОН
В этом примере примечательно то, что, начиная проводить реакцию в нейтральной среде, получаем щелочную среду. Вообще, часто мы даже можем не знать некоторые не основные продукты той или иной реакции, но с помощью данного метода уравнивания эти вещества могут быть получены (выведены) в процессе составления полуреакций. Также здесь интересен момент выведения определенного количества молекул воды, и взаимного уничтожения их слева и справа.
Давайте представим, что мы не знаем, что в результате получится гидроксид калия:
Na2SO3 + KM n O4 + H2O à MnO2 + Na 2 SO 4 + …… (КОН)

 SO3-2 + H2O -2 ē à SO42- + 2 H+ 3 в-ль, ок-ие (как кисл. ср.)
SO3-2 + H2O -2 ē à SO42- + 2 H+ 3 в-ль, ок-ие (как кисл. ср.)
MnO4- + 2H2O + 3 ē à MnO2 + 4 OH- 2 ок-ль, в-ие (как щелоч. ср.)
______________________________________________________
 |

 3SO32- + 3H 2O +2 MnO4- + 4H2O à 3SO42- + 6 H+ +2 MnO2 + 8 OH-
3SO32- + 3H 2O +2 MnO4- + 4H2O à 3SO42- + 6 H+ +2 MnO2 + 8 OH-
 6 OH- + 2 OH-
6 OH- + 2 OH-
 |

 7 H2O 6H2O u 2 OH—
7 H2O 6H2O u 2 OH—
3SO32- +2 MnO4-- +H2O à 3SO42- +2 MnO2 + 2 OH—
Как видно из суммарного ионного уравнения:
- слева 3 и 4 молекулы воды дают в суме 7 молекул;
- справа 6 катионов водорода и 6 гидроксид-анионов образуют 6 молекул воды;
- справа остаются свободными 2 гидроксид-аниона;
- слева и справа уничтожаем по 6 молекул воды;
- слева остается 1 молекула воды, а справа 2 гидроксид-аниона.
Подпишем недостающие ионы с противоположными знаками, и получим полное ионное уравнение:
6 Na+ + 3SO32- + 2 К+ + 2 MnO4- +H2O à6 Na+ + 3SO42- +2 MnO2 + 2 К+ + 2OH—
Молекулярное уравнение будет выглядеть:
3Na2SO3 + 2KM n O4 + H2O à 2 MnO2 + 3 Na 2 SO 4 + 2КОН
По количеству атомов кислорода (18=18) делаем вывод: уравнение составлено правильно.
Правила уравнивания
| В левой части уравнения | среда | добавляем в левую часть | добавляем в правую часть |
| Избыток кислорода | кислая | 2nН+ | nН2О |
| щелочная или нейтральная | nН2О | 2n ОН- | |
| Недостаток кислорода | кислая или нейтральная | nН2О | 2nН+ |
| щелочная | 2n ОН- | nН2О |
n - избыток атомов кислорода
Алгоритм действий при уравнивании
1) выяснить, что в реакции является окислителем и восстановителем;
2) для сильных электролитов выписать ионы - окислители и восстановители и продукты реакции; осадки, газы, простые вещества, оксиды и другие слабые электролиты и не электролиты записываем целиком;
|
|
|
3) выполняем баланс по атомам;
4) используя правила уравнивания в соответствующей среде составляем уравнение.
6. ПРЕВРАЩЕНИЕ НЕКОТОРЫХ ИОНОВ И ВЕЩЕСТВ В ОВР В РАЗЛИЧНЫХ СРЕДАХ.
Один и тот же ион или вещество в зависимости от сред, в которой протекает реакция, может претерпевать превращения различной степени глубины. Так например, перманганат-ион наибольшее количество электронов принимает в кислой среде, то есть, превращения в этом случае более глубокие, чем в нейтральной и щелочной среде.
Необходимо знать превращения и таких соединений, как дихромат-аниона и молекул пероксида водорода.
Превращение перманганат-аниона
+OH- (+1ē) +6

 MnO42- манганат –зеленого цвета
MnO42- манганат –зеленого цвета
анион
+7 +H2O (+3ē) +4


 MnO4- MnO2 оксид марганца (+4) - черного цвета
MnO4- MnO2 оксид марганца (+4) - черного цвета
+Н+ (+5ē)
Mn2+ катион марганца (+2) бесцветный
Чаще реакции протекают в кислой среде и применяются они, например, в методе перманганатометрии в аналитической химии. Ниже приводится схема превращений перманганата калия под действием различных восстановителей в кислой среде. В ней так же приводятся и другие продукты, которые получаются наряду с основным веществом.
Cхема превращений перманганата калия в кислой среде:
Основной продукт восстановления Кислота Восстановитель Продукт окисления

 MnCl2 HCl HCl à Cl2
MnCl2 HCl HCl à Cl2


 H2SO4 H2O2 à O2
H2SO4 H2O2 à O2
H2SO4
 KMnO4 KI à I2 + H2O
KMnO4 KI à I2 + H2O
 | 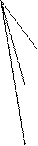 | ||
 H2SO4 Na2SO3à Na2SO4
H2SO4 Na2SO3à Na2SO4
 MnSO4 H2SO4 FeSO4 à Fe2(SO4)3
MnSO4 H2SO4 FeSO4 à Fe2(SO4)3
 H2SO4 H2C2O4 à CO2
H2SO4 H2C2O4 à CO2
Превращение ионов хрома:
Окисление (-3ē)
 | |||
 |
Восстановление (-3ē)
Степень окисления: +3 +6
Кислая среда: Cr3+ Сr2O72-
катион хрома +3 (зеленый) дихромат-анион (оранжевый)
Щелочная среда: CrO2- CrO42-
метахромит-анион (б/цв.) хромат-анион (желтый)
Cхема превращений дихромата калия в кислой среде:
Основной продукт восстановления Кислота Восстановитель Продукт окисления

 CrCl3 HCl HCl à Cl2
CrCl3 HCl HCl à Cl2

 H2SO4 H2S à S
H2SO4 H2S à S

 K2Cr2O7 H2SO4 KI à I2 + H2O
K2Cr2O7 H2SO4 KI à I2 + H2O
 | |||||
 |  | ||||


 H2SO4 Na2SO3à Na2SO4
H2SO4 Na2SO3à Na2SO4
 Cr2(SO4)3 H2SO4 FeSO4 à Fe2(SO4)3
Cr2(SO4)3 H2SO4 FeSO4 à Fe2(SO4)3
Превращение пероксида водорода:
-1 Н+ -2
H2O2 à H2O или
-1 OH- -2
H2O2 à ОH- в этих случаях пероксид водорода –окислитель
(2 атома «О» + 2ē)
-1 Н+ 0
H2O2 à O2 здесь пероксид водорода восстановитель
(2 атома «О» - 2ē)
7. ВЫЧИСЛЕНИЕ ЭКВИВАЛЕНТА ВЕЩЕСТВА В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЯХ
а) Эквивалент – это условная или реальная частица, которая в данной химической реакции эквивалентна 1 е –ну, или 1 протону, или одному одновалентному катиону (способна замещать или присоединять 1 грамм водорода).
Эквивалент – есть 1/z* часть частицы (молекулы, атома). Z* - это число эвивалентности.
Если Z* = 1, то эквивалент идентичен самой частице (реальная частица).
Если Z* = 2,3,4 и т.д., то эквивалент идентичен какой-то части молекулы или атома (условная частица - 1/ z*).
У окислителей и восстановителей Z* будет равно числу принятых или отданных электронов. Например, для процесса: Mn+7 +5e à Mn2 Z* = 5. От молекулы КMnO4 эквавалентной одному электрону будет только 1/5 часть.
б) Количество вещества эквивалента: ν 1/Z* = Z*.νx (число эквивалентности - z, количество вещества ν)
Пример: Рассчитать количество вещества эквивалента ν 1/Z* для 2-х моль KMnO4 при превращении: MnO4- +8 H+ +5е à Mn2+ + 4H2O
Z* = 5
 Дано: Решение:
Дано: Решение:
ν = 2 моль ν 1/Z* = Z*.vx = 5.2 = 10 моль – экв.

ν 1/Z* =?
Это значит, что в 1 моль перманганата калия содержится 5 условных частиц, эквивалентных одному электрону, а в двух молях 10 условных частиц.


Mx
 в) Молярная масса эквивалента: M 1/Z* = (г/моль, кг/кмоль)
в) Молярная масса эквивалента: M 1/Z* = (г/моль, кг/кмоль)
Z*
 |
Пример: Рассчитать молярную массу эквивалента KBrO3 в реакции:
KBrO3 + 6KI + 6HCl à KBr + 6KCl + 3I2 + 3 H2O
 Дано: Решение:
Дано: Решение:
BrO3 - + 6H+ +6e àBr- + 3 H2O
Z* = 6
M KBrO3 = 167 г/моль M KBrO3 167
M 1/Z* = ------------- = ----------- = 27,83 г/моль
 Z* 6
Z* 6
M 1/Z* =?
Это значит, что молярная масса условной частицы, эквивалентной одному электрону в данном процессе в 6 раз меньше молярной массы реальной частицы - одного моль вещества.
г) Молярная концентрация эквивалента
С 1/Z* - это число моль - эквивалентных масс, содержащихся в 1 дм3
(1 л) раствора.



ν 1/Z*
С 1/Z* = ------------
 V
V
m
т.к. ν 1/Z* = -------, то
M 1/Z*
m
С 1/Z* = -----------
M 1/Z*. V
Так как ν 1/Z* = Z*. ν, то


 Z*. ν
Z*. ν
С 1/Z* = ---------------- = Z* ∙ C; С 1/Z* = Z* ∙ C
 V
V
Это значит, что молярная концентрация эквивалента больше молярной концентрации в Z* раз (условных «дробных» частиц в одном и том же объеме больше, чем целых реальных частиц одного и того же количества вещества в данном объеме раствора).
Для расчетов используется также обратная величина числу эквивалентов f - фактор эквивалентности. Эта величина показывает часть от реальной частицы, которая эквивалентна одному электрону.
f = 1/ Z*
Так, для КMnO4 в ОВР при переходе к Mn2+ f = 1/ 5.
Соответственно при расчете всех выше перечисленных величин (молярной массы эквивалента и др.) в формулах f нужно поставить в дроби в противоположную сторону, от Z*.
Примеры расчета числа эквивалентов веществ в некоторых ОВР
При расчете будем пользоваться следующим алгоритмом:
1. Запишем полуреакцию, в которой участвует необходимое для расчета вещество или его ионы;
2. Рассчитаем количество переходящих электронов;
3. Число электронов и будет равняться числу эквивалентов Z*;
4. Если требует задача, то рассчитать по формулам величины: количества эквивалентов вещества, молярной массы эквивалента вещества, молярной концентрации эквивалента вещества.
Пример 1. Рассчитать число экваивалентов для пероксида водорода в
реакции:
5H2O2 + KM n O4 + 3 H2SO4 à 2 MnSO4 +K2SO4 + О2 +8H 2O
Ответ.
1. Записываем полуреакцию в любом из двух видов:
2О- à O2
H2O2 à O20 + 2 H+
2. Подставляем количество ушедших электронов:
2О- - 2 е à O2
H2O2 - 2 е à O20 + 2 H+
3. Число эквивалентов Z* = 2, фактор эквивалентности f = 1/ 2
Пример 2. Рассчитать число экваивалентов для тиосульфата натрия в
реакции:
2 Na2S 2O3 + I2 à 2 NaI + Na2S 4O 6
Ответ: в этом случае расчет лучше производить, используя ионно-электронный метод.
Составляем уравнение полуреакции:
2 S2O32- -2e à S4O62-
Обратите внимание на то, что два тиосульфат-аниона отдают 2 электрона и эти два аниона входят в состав двух молекул вещества. Таким образом, на один электрон приходится одна молекула тиосульфата натрия. Число Z* (Na2S 2O3 ) = 1.
Задание 1.
Рассчитайте число эквивалентов и фактор эквивалентности для йода в примере 2.
Задание 2.
Рассчитайте число эквивалентов и количество вещества эквивалентов для восстановителя в реакции а) на странице 3. Масса восстановителя равна 18 граммам. (подсказка: сначала рассчитайте обычное количество вещества.).
Задание 3.
Рассчитайте число эквивалентов и молярную массу эквивалента для окислителя в реакции г) на странице 3.
Задание 4.
Рассчитайте число эквивалентов и молярную концентрацию эквивалента для окислителя в реакции д) на странице 4. Масса окислителя равна 8,35 граммам.
Литература
1. Е.В.Барковский, С.В.Ткачев. Аналитическая химия. Минск., «Вышэйшая школа», 2004.
2. Л.М.Пустовалова, И.Е. Никанорова. Неорганическая химия. Ростов-на-Дону. «ФЕНИКС», 2005.
3. Вершинин В. И., «Аналитическая химия». Москва «Высшая школа», 2011, 448 с.
4. Харитонов Ю.А. «Аналитическая химия (аналитика)» в 2 кн. М.: Высшая школа, 2008 г, 559 с.
|
|
|


